题目内容
1.下列化学方程式的书写正确的是( )| A. | 硝酸见光分解:4HNO3$\frac{\underline{\;光照\;}}{\;}$4NO2↑+O2↑+2H2O | |
| B. | 往NaOH溶液中通入过量二氧化硫:2NaOH+SO2═Na2SO3+H2O | |
| C. | SO2气体通入BaCl2溶液中产生白色沉淀:SO2+BaCl2+H2O═BaSO3↓+2HCl | |
| D. | Fe与稀H2SO4反应的化学方程式为:2Fe+3H2SO4═Fe2(SO4)3+3H2↑ |
分析 A.浓硝酸受热分解产生二氧化氮、氧气和水;
B.往NaOH溶液中通入过量二氧化硫应生成NaHSO3;
C.SO2气体通入BaCl2溶液中不会产生白色沉淀;
D.Fe与稀H2SO4反应生成硫酸亚铁和氢气.
解答 解:A.浓硝酸光照分解产生二氧化氮、氧气和水,产生的NO2气体溶于硝酸,使浓硝酸呈棕黄色,硝酸分解的化学方程式为:4HNO3(浓)$\frac{\underline{\;光照\;}}{\;}$4NO2↑+O2↑+2H2O,故A正确;
B.向氢氧化钠溶液中慢慢地通入二氧化硫气体,反应生成正盐Na2SO3,继续通入过量二氧化硫时正盐Na2SO3便转化成酸式盐NaHSO3,反应为:SO2+NaOH=NaHSO3,故B错误;
C.亚硫酸的酸性弱于盐酸,SO2气体通入BaCl2溶液中,未见白色沉淀,只发生二氧化硫与水的反应,与氯化钡不发生反应,故C错误;
D.Fe与稀H2SO4反应:Fe+H2SO4═FeSO4+H2↑,故D错误;
故选A.
点评 本题考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等,题目难度不大,注意B反应物量的不同产物不同为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.下列分子或离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
| A. | NH4+ | B. | PH3 | C. | H3O+ | D. | H2S |
9.二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:H2S+Na2CO3═NaHS+NaHCO3.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)△H=-246.4KJ•mol-1;
则该反应D.
A.任何温度下都能进行 B.任何温度下都不能进行
C.高温下能自发进行 D.低温下能自发进行
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ce(以上都填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04 mol•L-1.
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:H2S+Na2CO3═NaHS+NaHCO3.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)△H=-246.4KJ•mol-1;
则该反应D.
A.任何温度下都能进行 B.任何温度下都不能进行
C.高温下能自发进行 D.低温下能自发进行
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ce(以上都填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04 mol•L-1.
16.下列关于常见有机物的说法不正确的是( )
| A. | C5H12属于烷烃且有三种同分异构体 | |
| B. | 乙酸、葡萄糖在一定条件下均能与Cu(OH)2反应 | |
| C. | 苯与浓硝酸、浓硫酸混合共热制取硝酸苯是发生取代反应 | |
| D. | 淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体 |
13.某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,通过水解除去杂质,需将溶液调至pH=4,在调节溶液pH时,应选用的试剂是( )
| A. | NaO | B. | ZnO | C. | Na2CO3 | D. | Fe2O3 |
11.80°C,0.1mol/L NaHB溶液中c(H+)>c(OH-),可能正确的关系是( )
| A. | c(Na+)+c(H+)=c(HB-)+2c(B2-) | B. | 溶液的pH=1 | ||
| C. | c(H+)?c(OH-)=10-14 | D. | c(Na+)=c(H2B)+c(HB-) |

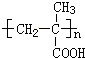 .
.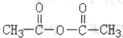 )作用制得.水杨酸的结构简式是
)作用制得.水杨酸的结构简式是 ,水杨酸可以看作羧酸类有机物,也可看作酚类有机物.
,水杨酸可以看作羧酸类有机物,也可看作酚类有机物.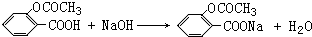 .
.