题目内容
18.下列各组元素的电负性大小顺序正确的是( )| A. | S<N<O<F | B. | S<O<N<F | C. | Si<Na<Mg<Al | D. | Br<H<Zn |
分析 一般来说,周期表从左到右,元素的电负性逐渐变大;周期表从上到下,元素的电负性逐渐变小.电负性大得元素集中在元素周期表的右上角,电负性小的元素集中在左下角,以此解答该题.
解答 解:A.同周期,从左到右,元素的电负性逐渐增大,从上到下,元素的电负性逐渐变小,则电负性S<N<O<F,故A正确;
B.同周期,从左到右,元素的电负性逐渐增大,电负性N<O,故B错误;
C.Na、Mg、Al为金属,电负性小于Si,故C错误;
D.Br的电负性大于H,Zn为金属,电负性最小,故D错误.
故选A.
点评 本题主要考查元素性质的变化规律,为高频考点,侧重考查学生的分析能力,注意把握电负性的大小比较方法以及递变规律,难度不大.

练习册系列答案
相关题目
8.下列物质与常用危险化学品的类别不对应的是( )
| A. | 浓H2SO4、NaOH--腐蚀品 | B. | 酒精--易燃气体 | ||
| C. | KMnO4--氧化剂 | D. | 甲烷--易燃气体 |
9.下列操作或仪器选用正确的是( )
| A. |  制取Fe(OH)2 | B. |  制取氧气 | ||
| C. |  滴定NaOH溶液 | D. |  除去乙醇中的乙酸 |
6.《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”.火药燃烧爆炸时发生的反应为:S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=x kJ•mol-1.
已知:
①碳的燃烧热△H1=a kJ•mol-1
②S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1
③2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1
则x为( )
已知:
①碳的燃烧热△H1=a kJ•mol-1
②S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1
③2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1
则x为( )
| A. | 3a+b-c | B. | c-3a-b | C. | a-b-c | D. | c-a-b |
13.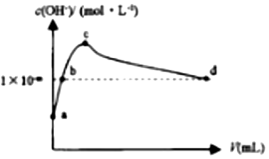 常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
 常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 | |
| B. | b点溶液中:c(H+)=1×10-mmol•L-1 | |
| C. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | d点溶液中:c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-) |
3.下列关于NO2的说法正确的是( )
| A. | NO2 是无色气体 | |
| B. | NO2 能用排水气法收集 | |
| C. | NO2能与水反应,在反应中氮元素的化合价不发生变化 | |
| D. | NO2能与水反应,在反应中NO2既是氧化剂,又是还原剂 |
10.某烃中碳和氢的质量比是24:5,该烃在标准状况下的密度是2.59g/L,其分子式为( )
| A. | C2H6 | B. | C4H10 | C. | C5H12 | D. | C4H8 |
7.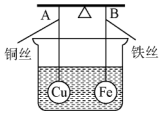 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )| A. | 杠杆为导体和绝缘体时,均为A端高B端低 | |
| B. | 杠杆为导体和绝缘体时,均为A端低B端高 | |
| C. | 当标杆为绝缘体时,A端低B端高;为导体时,A端高B端低 | |
| D. | 当标杆为绝缘体时,A端高B端低;为导体时,A端低B端高 |
8.YBa2Cu8Ox(Y为元素钇)是一种重要超导材料,下列关于${\;}_{39}^{89}$Y的说法错误的是( )
| A. | 质量数是89 | B. | 质子数与中子数之差为50 | ||
| C. | 核外电子数是39 | D. | ${\;}_{39}^{89}$Y与${\;}_{39}^{90}$Y互为同位素 |