题目内容
1.为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂均稍过量)称取粗盐$→_{①}^{溶解}$$→_{②}^{BaCl_{2}溶液}$$→_{③}^{NaOH溶液}$$→_{④}^{Na_{2}CO_{3}溶液}$$→_{⑤}^{过滤}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$粗盐
(1)加过量BaCl2溶液的原因是:使SO42-完全沉淀被除去
(2)如何运用最简单的方法检验溶液中有无SO42-离子取溶液适量于试管中,滴加足量盐酸使溶液酸化,再滴加几滴BaCl2溶液,若有白色沉淀生成,说明溶液中含有SO42-,若无白色沉淀生成,则说明溶液中不含SO42-.
分析 由流程可知,①中溶解,②中加氯化钡除去SO42-,③中NaOH除去Mg2+,④中碳酸钠除去Ca2+,⑤中过滤,滤液中加盐酸后蒸发、结晶得到精盐.
(1)除杂试剂过量,可将杂质完全转化为沉淀;
(2)加盐酸排除干扰离子,再加氯化钡观察是否生成白色沉淀检验SO42-离子.
解答 解:(1)加过量BaCl2溶液的原因是使SO42- 完全沉淀被除去,故答案为:使SO42- 完全沉淀被除去;
(2)最简单的方法检验溶液中有无SO42-离子的方法为取溶液适量于试管中,滴加足量盐酸使溶液酸化,再滴加几滴BaCl2溶液,若有白色沉淀生成,说明溶液中含有SO42-,若无白色沉淀生成,则说明溶液中不含SO42-,
故答案为:取溶液适量于试管中,滴加足量盐酸使溶液酸化,再滴加几滴BaCl2溶液,若有白色沉淀生成,说明溶液中含有SO42-,若无白色沉淀生成,则说明溶液中不含SO42-.
点评 本题考查混合物分离提纯,为高频考点,把握元素化合物知识、除杂的原则及试剂加入顺序为解答的关键,侧重分析与实验能力的考查,注意碳酸钠一定在氯化钡之后,题目难度不大.

练习册系列答案
相关题目
9.用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
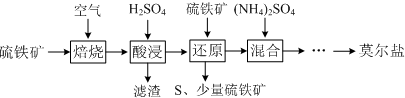
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++FeS2═2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是pH过高时铁元素将沉淀导致产率降低,写出“还原”时反应Ⅱ的离子方程式:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7.计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份.一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL.试确定莫尔盐的化学式(请给出计算过程).

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++FeS2═2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是pH过高时铁元素将沉淀导致产率降低,写出“还原”时反应Ⅱ的离子方程式:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7.计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)
| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| SO42- | 3.20 | 3.50 |
| Fe2+ | 0.15 | 3.30 |
16.如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
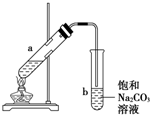

| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 长玻璃导管只有导气的作用 |
6.X、Y、Z、W为原子序数依次增大的短周斯元素,相关信息如图所示.下列判断正确的是( )

| A. | 原子半径:r(W)>r(Z)>r(Y) | |
| B. | 含Y元素的盐溶液一定显酸性 | |
| C. | 最高价氧化物对应水化物的酸性:Z>W | |
| D. | X、W分别形成的简单气态氢化物可反应生成离子化合物 |
13.1000ml某待测溶液中除含有0.2mol•L-1的Na+外,还可能含有下列离子中的一种或多种:
现进行如下实验操作(每次实验所加试剂均过量):
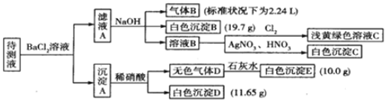
(1)写出生成白色沉淀B的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O.
(2)待测液中肯定不存在的阳离子是Fe3+、Ba2+.
(3)若无色气体D是单一气体:判断原溶液中K+是否存在存在(填是或否),若存在,求其物质的量浓度的最小值,若不存在,请说明理由:由电荷守恒可知K+离子最小浓度为0.1mol/L.
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是CO32-、HCO3-、SO32-.
②沉淀A中能与稀硝酸反应的成分是BaCO3、BaSO3(写化学式).
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |

(1)写出生成白色沉淀B的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O.
(2)待测液中肯定不存在的阳离子是Fe3+、Ba2+.
(3)若无色气体D是单一气体:判断原溶液中K+是否存在存在(填是或否),若存在,求其物质的量浓度的最小值,若不存在,请说明理由:由电荷守恒可知K+离子最小浓度为0.1mol/L.
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是CO32-、HCO3-、SO32-.
②沉淀A中能与稀硝酸反应的成分是BaCO3、BaSO3(写化学式).
10.A、B、C、D、E均是由下列离子组成的可溶性化合物.组成这五种物质的离子有(离子不能重复组合):
分别取它们进行实验,结果如下:
①A溶液与D溶液混合,没有明显现象;
②当B溶液加入到D溶液中时,有沉淀产生.继续加入B溶液,沉淀全部消失.
③将E溶液加热,有沉淀生成.
据此推断:AFe2(SO4)3;BBa(OH)2;CNa2CO3;DAlCl3;EMg(HCO3)2.
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ Fe3+ |
| 阴离子 | OH- Cl- CO32- SO42- HCO3- |
①A溶液与D溶液混合,没有明显现象;
②当B溶液加入到D溶液中时,有沉淀产生.继续加入B溶液,沉淀全部消失.
③将E溶液加热,有沉淀生成.
据此推断:AFe2(SO4)3;BBa(OH)2;CNa2CO3;DAlCl3;EMg(HCO3)2.
