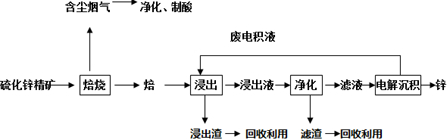
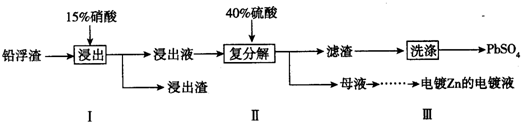
题目内容
13.事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.(填字母)A.C(s)+CO2(g)=2CO(g)△H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0
C.2CO(g)+O2(g)=2CO2(1)△H<0.
分析 常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应.
解答 解:A.C(s)+CO2(g)=2CO(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;
C.2CO(g)+O2(g)=2CO2(1)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C正确;
故答案为:C.
点评 本题考查原电池的构成条件,明确原电池与氧化还原反应的关系及负极发生氧化反应是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
4.下列说法中正确的是( )
| A. | 常温下0.4 mol/L HB溶液和 0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 等浓度的下列稀溶液:①硫酸氢钠 ②乙酸钠 ③醋酸 ④碳酸氢钠 ⑤硝酸钠 ⑥苯酚钠,它们的pH由小到大排列为:③⑤①④②⑥ | |
| C. | 常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中c (NH4+)由大到小的顺序是:②>①>④>③ | |
| D. | 在25℃时,将a mol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合反应时溶液中c(NH4+)=c(Cl-).用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
8.向X的溶液中,加入Y试剂,产生的沉淀示意图如图所示情形的是(注意线段的斜率)( )
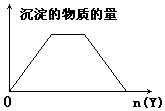

| A. | 向NaOH和Ca(OH)2的混合液中通入CO2 | |
| B. | 向HCl和AlCl3的混合液中滴加NaOH | |
| C. | 向NH4Cl和AlCl3的混合液中滴加NaOH | |
| D. | 向含NaOH的NaAlO2溶液中滴加盐酸 |
18.下列离子在溶液中能大量共存的是( )
| A. | Mg2+、K+、Cl-、AlO2- | B. | Al3+、Na+、NO3-、HCO3- | ||
| C. | NH4+、Fe3+、SO42-、NO3- | D. | Ca2+、H+、NO3-、S2O32- |
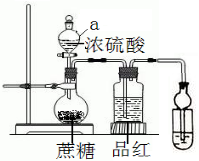 在烧瓶放20克蔗糖,依次加入少量水、20mL浓硫酸,蔗糖逐渐变黑,体积膨胀,形成疏松多孔的黑面包,烧瓶发烫,品红溶液颜色变淡.请回答:
在烧瓶放20克蔗糖,依次加入少量水、20mL浓硫酸,蔗糖逐渐变黑,体积膨胀,形成疏松多孔的黑面包,烧瓶发烫,品红溶液颜色变淡.请回答: