题目内容
氯气在工农业生产中应用非常广泛.请回答以下问题:
(1)如图1是三位同学分别设计的实验室制取和收集氯气的装置,其中最好的是 (填序号):
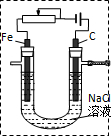
(2)某课外小组同学用如图2所示装置通过电解食盐水并探究氯气相关性质,请回答:
①现有电极:C和Fe供选择,请在虚框中补画导线、电源( ),串联变阻器以调节电流,同时标出电极
),串联变阻器以调节电流,同时标出电极
材料;电解的离子反应方程式为 .
②通电一段时间后,玻璃管A、B、C三处是浸有不同溶液的棉花,其中A、B两处的颜色变化分别为 、 ;C处发生的离子反应方程式为 .
③为防止氯气逸出造成污染,应采取的措施是 .
(3)当在阴极收集到气体448mL后停止实验,将U形管溶液倒于量筒中测得体积为400mL,则摇匀后理论上计算得溶液pH= .
(1)如图1是三位同学分别设计的实验室制取和收集氯气的装置,其中最好的是

(2)某课外小组同学用如图2所示装置通过电解食盐水并探究氯气相关性质,请回答:
①现有电极:C和Fe供选择,请在虚框中补画导线、电源(
 ),串联变阻器以调节电流,同时标出电极
),串联变阻器以调节电流,同时标出电极材料;电解的离子反应方程式为
②通电一段时间后,玻璃管A、B、C三处是浸有不同溶液的棉花,其中A、B两处的颜色变化分别为
③为防止氯气逸出造成污染,应采取的措施是
(3)当在阴极收集到气体448mL后停止实验,将U形管溶液倒于量筒中测得体积为400mL,则摇匀后理论上计算得溶液pH=
考点:氯气的实验室制法
专题:实验题
分析:(1)分析装置图A加热氯水制备氯气,由于氯气溶解度小溶解的少的得不到大量氯气;装置B常温下氯酸钾和浓盐酸反应生成氯气用向上排气法收集,剩余气体用氢氧化钠溶液吸收;装置无尾气吸收装置;
(2)①电解氯化钠溶液生成氯气、氢气和氢氧化钠,生成氯气的一端电解为阳极;
②阳极氯气的氧化性和物质性质分析判断反应现象;
③在D处放置一团浸有氢氧化钠溶液的棉花,用来吸收多余的氯气,放置污染环境;
(3)阴极收集到的气体为H20.448L,n(H2)=0.448L÷22.4L/mol=0.02mol;由方程式:2Cl-+2H2O=Cl2↑+H2↑+2OH-得:n(OH-)=0.02mol×2=0.04mol;c(OH-)=0.04mol÷0.4L=0.1mol/L,计算得到溶液PH.
(2)①电解氯化钠溶液生成氯气、氢气和氢氧化钠,生成氯气的一端电解为阳极;
②阳极氯气的氧化性和物质性质分析判断反应现象;
③在D处放置一团浸有氢氧化钠溶液的棉花,用来吸收多余的氯气,放置污染环境;
(3)阴极收集到的气体为H20.448L,n(H2)=0.448L÷22.4L/mol=0.02mol;由方程式:2Cl-+2H2O=Cl2↑+H2↑+2OH-得:n(OH-)=0.02mol×2=0.04mol;c(OH-)=0.04mol÷0.4L=0.1mol/L,计算得到溶液PH.
解答:
解:(1)分析装置图A加热氯水制备氯气,由于氯气溶解度小溶解的少的得不到大量氯气;装置B常温下氯酸钾和浓盐酸反应生成氯气用向上排气法收集,剩余气体用氢氧化钠溶液吸收;装置无尾气吸收装置,所以选择B;
故答案为:B;
(2)①电解氯化钠溶液生成氯气、氢气和氢氧化钠,生成氯气的一端电解为阳极,其中电源和导线、通电、电极标注如图所示:
 ;电解的离子反应方程式为:2Cl-+2H2O
;电解的离子反应方程式为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
故答案为: ;2Cl-+2H2O
;2Cl-+2H2O
Cl2↑+H2↑+2OH-;
②通电一段时间后,玻璃管A、B、C三处是浸有不同溶液的棉花,其中A发生的反应Cl2+2I-=I2+2Cl-,碘单质遇到淀粉变蓝色,溶液无色变化为蓝色;B处发生的反应2FeCl2+Cl2=3FeCl2,溶液的颜色变化为溶液浅绿色变黄色;C处发生的离子反应方程式为:Cl2+SO32-+H2O═2Cl-+SO42-+2H+;
故答案为:无色变蓝色;浅绿色变黄色;Cl2+SO32-+H2O═2Cl-+SO42-+2H+;
③在D处放置一团浸有氢氧化钠溶液的棉花,用来吸收多余的氯气,放置污染环境,故答案为:在D处放一团浸有NaOH溶液的棉花;
(3)阴极收集到的气体为H20.448L,n(H2)=0.448L÷22.4L/mol=0.02mol;
由方程式:2Cl-+2H2O=Cl2↑+H2↑+2OH-:
计算得到n(OH-)=0.02mol×2=0.04mol;
c(OH-)=0.04mol÷0.4L=0.1mol/L
c(H+)=10-13mol/L
则pH=-lg10-13=13
故答案为:13.
故答案为:B;
(2)①电解氯化钠溶液生成氯气、氢气和氢氧化钠,生成氯气的一端电解为阳极,其中电源和导线、通电、电极标注如图所示:
 ;电解的离子反应方程式为:2Cl-+2H2O
;电解的离子反应方程式为:2Cl-+2H2O
| ||
故答案为:
 ;2Cl-+2H2O
;2Cl-+2H2O
| ||
②通电一段时间后,玻璃管A、B、C三处是浸有不同溶液的棉花,其中A发生的反应Cl2+2I-=I2+2Cl-,碘单质遇到淀粉变蓝色,溶液无色变化为蓝色;B处发生的反应2FeCl2+Cl2=3FeCl2,溶液的颜色变化为溶液浅绿色变黄色;C处发生的离子反应方程式为:Cl2+SO32-+H2O═2Cl-+SO42-+2H+;
故答案为:无色变蓝色;浅绿色变黄色;Cl2+SO32-+H2O═2Cl-+SO42-+2H+;
③在D处放置一团浸有氢氧化钠溶液的棉花,用来吸收多余的氯气,放置污染环境,故答案为:在D处放一团浸有NaOH溶液的棉花;
(3)阴极收集到的气体为H20.448L,n(H2)=0.448L÷22.4L/mol=0.02mol;
由方程式:2Cl-+2H2O=Cl2↑+H2↑+2OH-:
计算得到n(OH-)=0.02mol×2=0.04mol;
c(OH-)=0.04mol÷0.4L=0.1mol/L
c(H+)=10-13mol/L
则pH=-lg10-13=13
故答案为:13.
点评:本题主要考查实验室制氯气的原理和氯气的性质,难度不大,掌握原理和物质的性质即可解答,需要注意的是浓盐酸和二氧化锰能反应,但稀盐酸和二氧化锰不反应;次氯酸是弱酸,但次氯酸具有强氧化性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列解释事实的离子方程式正确的是( )
| A、铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| B、向Ca(ClO)2溶液中通入过量CO2制取次氯酸:2ClO-+H2O+CO2=2HClO+CO32- |
| C、向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O |
| D、0.01 mol?L-1NH4Al(SO4)2溶液与0.02 mol?L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O |
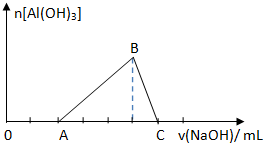 已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38.向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成Al(OH)3沉淀的物质的量与加入NaOH溶液体积的关系如图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( )
已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38.向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成Al(OH)3沉淀的物质的量与加入NaOH溶液体积的关系如图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( )| A、原混合溶液中c(Fe3+):c(Al3+)=1:1 |
| B、B点两种沉淀共存,此时上层清液中c(Fe3+)=c(Al3+)=0 |
| C、B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104:1 |
| D、C点溶液中的溶质只有NaAlO2 |
下列离子方程式正确的是( )
A、等物质的量的NH4HCO3与Ba(OH)2溶液混合后加热:NH4++OH-
| ||||
| B、酸性的淀粉碘化钾溶液在空气中变蓝:4I-+O2+4H+=2H2O+2I2 | ||||
| C、1molCl2通入含1mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | ||||
| D、过量SO2通入Ba(NO3)2溶液中:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+ |
pH=3的盐酸a L分别与下列三种溶液混合后,溶液均呈中性:其中a、b、c、d的关系正确的是( )
①1×10-3 mol?L-1的氨水b L
②1×10-3 mol?L-1的氨水c L
③1×10-3 mol?L-1的Ba(OH)2溶液d L.
①1×10-3 mol?L-1的氨水b L
②1×10-3 mol?L-1的氨水c L
③1×10-3 mol?L-1的Ba(OH)2溶液d L.
| A、b>a>d>c |
| B、b>a=d>c |
| C、a=b>c>d |
| D、c>a=d>b |


 短周期元素A、B、C、D、E,其中A、B、C、D在元素周期表中的位置如图所示,A、B、C原子的最外层电子数之和为17,E是短周期中原子半径最大的主族元素.请回答下列问题:
短周期元素A、B、C、D、E,其中A、B、C、D在元素周期表中的位置如图所示,A、B、C原子的最外层电子数之和为17,E是短周期中原子半径最大的主族元素.请回答下列问题:

 是一种高分子材料,其单体的结构简式是
是一种高分子材料,其单体的结构简式是