题目内容
1.已知强酸与强碱的稀溶液发生中和反应的热化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,向0.1L 0.2mol•L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀盐酸,恰好完全反应.则其焓变△H1、△H2、△H3的关系是( )| A. | △H1>△H2>△H3 | B. | △H1>△H3>△H2 | C. | △H1=△H3>△H2 | D. | △H1<△H3<△H2 |
分析 强酸与强碱的稀溶液发生中和反应的热化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,结合醋酸电离吸热、浓硫酸稀释放热来解答.
解答 解:强酸与强碱的稀溶液发生中和反应的热化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,
①稀醋酸;②浓硫酸;③稀盐酸,恰好完全反应,
稀盐酸反应放出的热量为0.02×57.3kJ,醋酸电离吸热、浓硫酸稀释放热,醋酸反应放出的热量少,浓硫酸反应放出热量多,
且△H均为负值,则△H1>△H3>△H2,
故选B.
点评 本题考查反应热与焓变,为高频考点,把握物质的量与能量变化的关系为解答的关键,侧重分析与应用能力的考查,注意醋酸电离、浓硫酸稀释的能量变化,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
12.下列反应中,熵显著增加的反应是( )
①CO(g)+2H2(g)═CH3OH(g)
②CaCO3(s)+2HCl(aq)═CaCl2(aq)+CO2(g)+H2O(l)
③C(s)+O2(g)═CO2(g)
④2HgO(s)═2Hg(l)+O2(g)
①CO(g)+2H2(g)═CH3OH(g)
②CaCO3(s)+2HCl(aq)═CaCl2(aq)+CO2(g)+H2O(l)
③C(s)+O2(g)═CO2(g)
④2HgO(s)═2Hg(l)+O2(g)
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
9.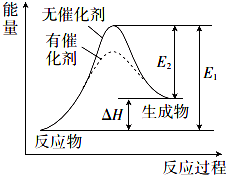 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )| A. | 该反应为吸热反应 | |
| B. | 催化剂不能改变反应的焓变(△H) | |
| C. | 催化剂能降低反应的活化能 | |
| D. | 逆反应的活化能大于正反应的活化能 |
16. 对于mA(s)+nB(g)?pC(g)△H<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)△H<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
 对于mA(s)+nB(g)?pC(g)△H<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
对于mA(s)+nB(g)?pC(g)△H<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )| A. | m+n<p | B. | n>p | ||
| C. | x点的状态是v正>v逆 | D. | 以上答案都错误 |
6.现有三组溶液:①水和植物油的混合物 ②提取白酒中的乙醇 ③氯化钠和单质溴的混合液.分离以上各混合液的正确方法依次( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
13.下列有关化学用语表示正确的是( )
| A. | 对烃基苯甲醛的结构简式: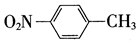 | B. | 质量数为37的氯原子:$\stackrel{37}{17}$Cl | ||
| C. | NH4Br的电子式: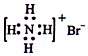 | D. | 二氧化碳分子的比例模型: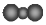 |
10.符合图中阴影部分的物质是( )


| A. | K2SO3 | B. | K2S2O3 | C. | K2 SO4 | D. | KHSO4 |
11.乙酸丁酯(CH3COOCH2CH2CH2CH3)是具有果香味的香精,经酯化反应可进行乙酸丁酯的合成.有关物质的物理性质见表.合成过程如下:第一步:将丁醇和过量的乙酸混合加热发生酯化反应;第二步:洗涤提纯;第三步:蒸馏提纯.
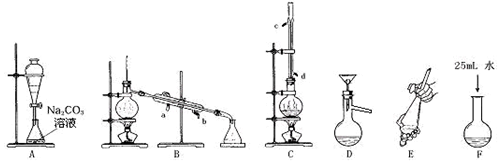
(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)
C→F→E→A→D→B.
(2)C装置中除了装有1-丁醇和过量的乙酸外,还需要加入浓硫酸、沸石.装置C中冷凝管的作用是:冷凝回流挥发的乙酸和丁醇;
(3)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是溶解吸收未反应的酸和醇.A装置中Na2CO3溶液的作用是除去乙酸丁酯中过量的乙酸.
(4)装置A的分液漏斗中液体分为两层,乙酸丁酯应在上(填上、下)层.
(5)第一步酯化反应过程中可能得到的有机副产物有CH2=CH-CH2-CH3,CH3-CH2-CH2-CH2-O-CH2-CH2-CH2-CH3(写出两种物质的结构简式).
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.3 |
| 密度/g•cm-3 | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 互溶 | 不溶 |

(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)
C→F→E→A→D→B.
(2)C装置中除了装有1-丁醇和过量的乙酸外,还需要加入浓硫酸、沸石.装置C中冷凝管的作用是:冷凝回流挥发的乙酸和丁醇;
(3)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是溶解吸收未反应的酸和醇.A装置中Na2CO3溶液的作用是除去乙酸丁酯中过量的乙酸.
(4)装置A的分液漏斗中液体分为两层,乙酸丁酯应在上(填上、下)层.
(5)第一步酯化反应过程中可能得到的有机副产物有CH2=CH-CH2-CH3,CH3-CH2-CH2-CH2-O-CH2-CH2-CH2-CH3(写出两种物质的结构简式).