题目内容
12.下列反应中,熵显著增加的反应是( )①CO(g)+2H2(g)═CH3OH(g)
②CaCO3(s)+2HCl(aq)═CaCl2(aq)+CO2(g)+H2O(l)
③C(s)+O2(g)═CO2(g)
④2HgO(s)═2Hg(l)+O2(g)
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
分析 结合反应中气体的化学计量数可知,反应前后气体的化学计量数之和变大,则熵显著增加,以此来解答.
解答 解:①CO(g)+2H2(g)═CH3OH(g)中1+2>1,熵显著减小,故不选;
②CaCO3(s)+2HCl(aq)═CaCl2(aq)+CO2(g)+H2O(l)中,反应前无气体,反应后生成气体,熵显著增加,故选;
③C(s)+O2(g)═CO2(g)中△S=0,故不选;
④2HgO(s)═2Hg(l)+O2(g)中,反应前无气体,反应后生成气体,熵显著增加,故选;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中气体的化学计量数为解答的关键,侧重分析与应用能力的考查,注意气体的物质的量增大时熵增加,题目难度不大.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
3. 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | 增大压强,平衡向正反应方向移动 |
20.下列说法正确的是( )
| A. | 放热反应在常温下一定是很容易发生 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 在稀溶液中,1 mol酸与1mol碱发生中和反应时所释放的热量叫中和热 | |
| D. | 一个反应是放热还是吸热,主要取决于反应物总能量与生成物总能量的相对大小 |
7.图I 是NO2(g)+CO(g)?CO2(g)+NO(g)反应过程中能量变化的示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态.当改变其中一个条件X,Y随X的变化关系曲线如图II所示.

下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 一定条件下,向密闭容器中加入1molNO2(g)与1molCO(g)反应放出234kJ热量 | |
| B. | 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 | |
| C. | 若X表示反应时间,则Y表示的可能是混合气体的密度 | |
| D. | 若X表示温度,则Y表示的可能是CO2的物质的量浓度 |
4.在相同温度下,下列两个反应放出的热量分别用Q1和Q2表示:
H2(g)+$\frac{1}{2}$O2(g)=H2O(g) Q1
2H2(g)+O2(g)=2H2O(l) Q2
下列有关Q1和Q2的关系说法正确的是( )
H2(g)+$\frac{1}{2}$O2(g)=H2O(g) Q1
2H2(g)+O2(g)=2H2O(l) Q2
下列有关Q1和Q2的关系说法正确的是( )
| A. | Q1=Q2 | B. | Q1=$\frac{1}{2}$Q2 | C. | Q1<$\frac{1}{2}$Q2 | D. | Q1>$\frac{1}{2}$Q2 |
1.已知强酸与强碱的稀溶液发生中和反应的热化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,向0.1L 0.2mol•L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀盐酸,恰好完全反应.则其焓变△H1、△H2、△H3的关系是( )
| A. | △H1>△H2>△H3 | B. | △H1>△H3>△H2 | C. | △H1=△H3>△H2 | D. | △H1<△H3<△H2 |
2.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| B. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| C. | 25℃,1标准大气压下,64g SO2 中含有的原子数为3NA | |
| D. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
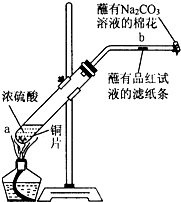 某化学实验小组为确认铜与浓硫酸反应的产物,设计如图实验装置.在一支试管中放入一块很小的铜片,再加入适量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中,塞紧试管口,在玻璃导管口处放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.回答下列问题:
某化学实验小组为确认铜与浓硫酸反应的产物,设计如图实验装置.在一支试管中放入一块很小的铜片,再加入适量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中,塞紧试管口,在玻璃导管口处放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.回答下列问题: