题目内容
14.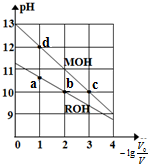 常温下,向体积均为V0、浓度均为0.10mol•L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随-lg$\frac{{v}_{0}}{v}$的变化如图所示,下列叙述正确的是( )
常温下,向体积均为V0、浓度均为0.10mol•L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随-lg$\frac{{v}_{0}}{v}$的变化如图所示,下列叙述正确的是( )| A. | b、c两点的溶液中:c(R+)>c(M+) | |
| B. | MOH的电离程度:c点小于d点 | |
| C. | 溶液中水的电离程度:b>c>a>d | |
| D. | 当-lg$\frac{{v}_{0}}{v}$=2时,若两溶液同时升高温度,则$\frac{c({R}^{+})}{c({M}^{+})}$增大 |
分析 A.根据电荷守恒分析;
B.弱电解质在水溶液中随着浓度的减小其电离程度增大;
C.溶液中氢氧根离子浓度越大,对水的抑制程度越大,水的电离程度越小;
D.MOH的碱性强于ROH的碱性,当-lg$\frac{{v}_{0}}{v}$=2时,若两溶液同时升高温度,促进弱电解质电离.
解答 解:A.MOH和ROH溶液中,电荷守恒为c(OH-)=c(H+)+c(M+),c(OH-)=c(H+)+c(R+),因为两个溶液中氢离子浓度相同,所以c(R+)=c(M+),故A错误;
B.由图示可以看出MOH为弱碱,弱电解质在水溶液中随着浓度的减小其电离程度增大,c点溶液体积大于d点,所以c点浓度小于d点,则ROH电离程度:c>d,故B错误;
C.溶液中氢氧根离子浓度越大,对水的抑制程度越大,水的电离程度越小,所以溶液中水的电离程度:b=c>ca>d,故C错误;
D.根据A知,碱性MOH>ROH,当-lg$\frac{{v}_{0}}{v}$=2时,由于ROH是弱电解质,升高温度能促进ROH的电离,所以$\frac{c({R}^{+})}{c({M}^{+})}$增大,故D正确;
故选D.
点评 本题考查弱电解质在水溶液中电离平衡,为高频考点,明确弱电解质电离特点、弱电解质电离程度与溶液浓度关系等知识点是解本题关键,易错选项是C,注意:碱无论任何稀释都不能变为中性溶液或酸性溶液,接近中性时要考虑水的电离,为易错点.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案
相关题目
4.为了鉴别乙烯、甲苯、苯酚溶液、乙醇溶液四种无色的液体,可以使用下列试剂合理的一组是( )
| A. | KMnO4酸性溶液 | B. | 银氨溶液 | ||
| C. | 溴水 | D. | 新制Cu(OH)2和FeCl3溶液 |
5.下列关于同分异构体数目的叙述不正确的是( )
| A. | 分子式为C5H12的烃有3种同分异构体 | |
| B. | 已知丙烷的二氯代物有4种同分异构体,则其六氯代物的同分异构体数目也为4种 | |
| C. | 含有5碳原子的饱和链烃,其一氯代物只有3种 | |
| D. | 菲的结构为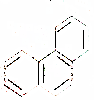 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
2.下列说法正确的是( )
| A. | 中和滴定实验时,用待测液润洗锥形瓶 | |
| B. | 用带玻璃塞的磨口瓶盛放NaOH溶液 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| D. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
9.室温时,0.01mol•L-1HA溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,下列有关叙述正确的是( )
| A. | 原HA溶液中,c(H+)=c(A-) | |
| B. | 当恰好完全中和时,溶液呈中性 | |
| C. | 当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 当滴入少量的NaOH,促进了HA的电离,溶液的pH升高 |
19.如图1所示:将30mL 0.1mol•L-1Ba(OH)2溶液置于烧杯中,然后慢慢加入0.1mol•L-1第三周期某元素形成的酸溶液共25mL,加入酸溶液的体积V与电流强度I的I-V图如图2所示.下列说法正确的是( )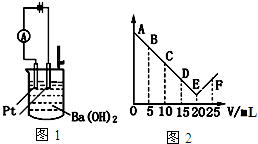

| A. | 此酸的化学式为HNO3 | |
| B. | 处于C点时溶液中导电的阳离子主要是Ba2+、NH4+ | |
| C. | 烧杯中刚加入酸时,观察不到有白色沉淀生成 | |
| D. | 从A→E电流强度I变小的主要原因是生成难溶的盐和难电离的水 |
6.在常温下,将VmL0.05mol.L-1的醋酸溶液缓慢滴加到10mol0.05mol•L-1的Na2CO3溶液中,并不断搅拌(气体完全逸出),所得溶液中微粒的物质的量浓度关系正确的( )
| A. | 当V=10时,c(Na+)>c(OH-)>c(HC0${\;}_{3}^{-}$)>c(CH3COO-)>c(H+) | |
| B. | 当 0<V<20 时,c(H+)+c(Na+)=c(HC0${\;}_{3}^{-}$)+c(CH3COO-)+2 c(C032-)+c(OH-) | |
| C. | 当 V=20 时,c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 当 V=40 时,c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
4.甲与乙在敞口容器里的溶液中的转化关系如图所示,甲不可能是( )
甲$\stackrel{OH-}{→}$乙$\stackrel{H+}{→}$甲.
甲$\stackrel{OH-}{→}$乙$\stackrel{H+}{→}$甲.
| A. | Fe2+ | B. | Al | C. | HCO${\;}_{3}^{-}$ | D. | CO2 |
 .
.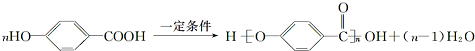 .
.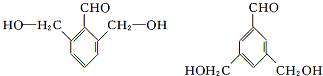 (任意一种).
(任意一种).