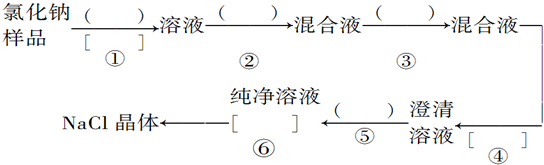
题目内容
12.实验室里迅速制备少量氯气可利用如下反应:2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑,此反应在常温下就可以迅速进行,而且对盐酸浓度要求不高.
(1)标出上述氧化还原反应中电子转移的方向和数目:
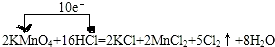 .
.(2)该反应中,氧化剂是KMnO4,还原剂是HCl.
(3)HCl在此反应过程中表现出的化学性质有AB.
A.酸性 B.还原性C.氧化性 D.挥发性
(4)结合此反应原理,联系实际思考,实验室处理含MnO4-的废液时,要特别注意什么问题?(氯气有毒)
MnO4-具有强氧化性,会与Cl-发生氧化还原反应生成有毒的Cl2.
分析 (1)反应中,化合价升高元素是氯元素,失电子,化合价降低元素是锰元素,得到电子,化合价升高数=化合价降低数=转移电子数=10,单线桥表示氧化还原反应方程式时箭头由失电子的元素出发指向得电子的元素,在箭头的短线上标明转移的电子数目即可;
(2)所含元素化合价升高的是还原剂,所含元素化合价降低的是氧化剂;
(3)在氧化还原反应中,失电子化合价升高的元素被氧化体现还原性;如果有盐酸的氢离子参加了反应而酸根离子未参加反应,那么盐酸就表现出酸性;
(4)因为MnO4-具有强氧化性,会与Cl-发生氧化还原反应生成有毒的Cl2.
解答 解:(1)反应中,化合价升高元素是氯元素,失电子,化合价降低元素是锰元素,得到电子,化合价升高数=化合价降低数=转移电子数=10,单线桥表,反应中电子转移的方向和数目为: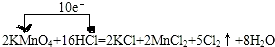 ;
;
故答案为: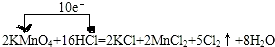 ;
;
(2)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O反应中,高锰酸钾中锰元素化合价降低,所以高锰酸钾做氧化剂,氯化氢中氯元素化合价升高,氯化氢为还原剂,故答案为:KMnO4;HCl;
(3)反应中氯元素的化合价升高,则氯元素失去电子,该反应中部分盐酸中Cl元素化合价不变、部分Cl元素化合价由-1价变为0价,所以浓盐酸作酸、还原剂,体现酸性和还原性;
故答案为:AB;
(4)MnO4-具有强氧化性,会与Cl-发生氧化还原反应生成有毒的Cl2,造成空气污染;
故答案为:MnO4-具有强氧化性,会与Cl-发生氧化还原反应生成有毒的Cl2.
点评 本题考查了氧化还原反应的相关概念和计算,明确氧化还原反应的实质是解题关键,注意分析化合价判断电子的转移数目,题目难度不大.

练习册系列答案
相关题目
3.把NaOH和Na2CO3混和物配制成100mL溶液,其中c(Na+)=0.5mol/L.在该溶液中加入过量盐酸反应完全后,将溶液蒸干后所得固体质量为( )
| A. | 2.93 g | B. | 5.85 g | C. | 6.56g | D. | 无法确定 |
20.下列指定反应的离子方程式正确的是( )
| A. | Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+HClO | |
| B. | 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl- | |
| C. | NH4HCO3溶液和少量的NaOH溶液混合:HCO3-+OH-═CO32-+H2O | |
| D. | 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-=2Fe2++I2 |
7.下列四个试管中,发生如下反应:CaCO3+2HCl═CaCl2+H2O+CO2↑,产生气体的速率最快的是( )
| 试管 | CaCO3的状态 | 盐酸的浓度 | 温度 |
| A | 块状 | 1mol•L-1 | 20℃ |
| B | 粉末状 | 1mol•L-1 | 20℃ |
| C | 块状 | 2mol•L-1 | 40℃ |
| D | 粉末状 | 2mol•L-1 | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
17.下列化学用语表示正确的是( )
| A. | 中子数为35的氯原子:${\;}_{17}^{35}$Cl | B. | 氯化铵的电子式: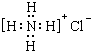 | ||
| C. | 硫化氢的结构式:H-S-H | D. | 二氧化硅的分子式:SiO2 |
4.下列物质不能使蛋白质变性的是( )
| A. | 紫外线 | B. | 福尔马林 | C. | 硫酸钠 | D. | 浓盐酸 |
20.如表列出了A-G 7种元素在周期表中的位置
(1)这7种元素中化学性质最不活泼的是Al(填元素符号)
(2)D元素的最高价氧化物对应水化物与氢氧化钠反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O
(3)A、B、C三种元素按原子半径由大到小的顺序排列为K>Na>Mg(填元素符号)
(4)E元素氢化物的结构式是H-O-H,该氢化物在常温下跟B发生反应的化学方程式是2K+2H2O=2KOH+H2↑.
(5)F元素跟A元素形成化合物的电子式是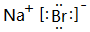 ,高温灼烧该化合物时,火焰呈黄色.
,高温灼烧该化合物时,火焰呈黄色.
(6)C.D的单质作电极,稀硫酸作电解质溶液,构成原电池.其负极的电极反应式为:Mg-2e-=Mg2+.
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | |||||||
| 3 | A | C | D | G | ||||
| 4 | B | F |
(2)D元素的最高价氧化物对应水化物与氢氧化钠反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O
(3)A、B、C三种元素按原子半径由大到小的顺序排列为K>Na>Mg(填元素符号)
(4)E元素氢化物的结构式是H-O-H,该氢化物在常温下跟B发生反应的化学方程式是2K+2H2O=2KOH+H2↑.
(5)F元素跟A元素形成化合物的电子式是
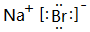 ,高温灼烧该化合物时,火焰呈黄色.
,高温灼烧该化合物时,火焰呈黄色.(6)C.D的单质作电极,稀硫酸作电解质溶液,构成原电池.其负极的电极反应式为:Mg-2e-=Mg2+.
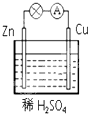 在如图所示的锌铜原电池中,Zn作原电池的负极,电极上发生的是氧化反应(填“氧化”或“还原”),该电极反应式为Zn-2e-=Zn2+,观察到的现象为锌片溶解;Cu作原电池的正 极,电极上发生的是还原反应(填“氧化”或“还原”),该电极反应式为2H++2e-=H2↑,观察到的现象为铜片上有气泡产生.
在如图所示的锌铜原电池中,Zn作原电池的负极,电极上发生的是氧化反应(填“氧化”或“还原”),该电极反应式为Zn-2e-=Zn2+,观察到的现象为锌片溶解;Cu作原电池的正 极,电极上发生的是还原反应(填“氧化”或“还原”),该电极反应式为2H++2e-=H2↑,观察到的现象为铜片上有气泡产生.