题目内容
20.下列指定反应的离子方程式正确的是( )| A. | Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+HClO | |
| B. | 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl- | |
| C. | NH4HCO3溶液和少量的NaOH溶液混合:HCO3-+OH-═CO32-+H2O | |
| D. | 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-=2Fe2++I2 |
分析 A.发生氧化反应生成硫酸钙,遵循电子、电荷守恒;
B.Fe2+与ClO-会发生氧化还原反应,生成的氢离子与次氯酸根离子结合生成次氯酸;
C.少量NaOH与碳酸氢根离子反应;
D.漏写硝酸根离子发生的氧化还原反应.
解答 解:A.Ca(ClO)2溶液中通入少量SO2的离子反应为Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+HClO,故A正确;
B.向FeCl2溶液加入足量NaClO溶液的离子反应为2Fe2++5ClO-+5H2O═2Fe(OH)3↓+Cl-+4HClO,故B错误;
C.NH4HCO3溶液和少量的NaOH溶液混合的离子反应为HCO3-+OH-═CO32-+H2O,故C正确;
D.向Fe(NO3)3溶液中加入足量的HI溶液的离子反应为3NO3-+12H++Fe3++10I-=Fe2++3NO↑+6H2O+5I2,故D错误;
故选AC.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.以下说法正确的是( )
| A. | mg的CO和H2混合气体充分燃烧后,生成的气体通入Na2O2固体中,固体质量增重mg | |
| B. | 将一定量的CO2气体通入足量的Na2O2固体中,固体量增重2.8g,则反应中有0.1mol电子转移 | |
| C. | 相同质量的铝分别与足量的盐酸和NaOH溶液反应,生成气体物质的量之比为1:3 | |
| D. | NaAlO2溶液中逐滴滴入盐酸至过量,生成的沉淀随着加入的元素所发生的变化如图所示: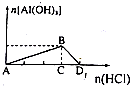 |
8.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: | |
| B. | 氯化镁的电子式: | |
| C. | N2的电子式: | |
| D. | 用电子式表示氯化氢分子的形成过程: |
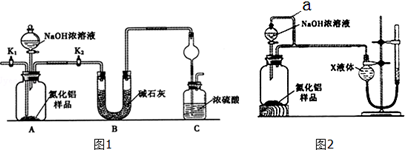
8.TiO2和TiCl4都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究.
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:

请回答下列问题:
(1)仪器A的名称是球形干燥管.
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N2一段时间,④加装药品,⑤点燃酒精灯⑥停止通N2⑦停止加热.正确的操作顺序是②①④③⑤⑦⑥
实验结束后欲分离D中的液态混合物,所采用操作的名称是蒸馏(或分馏).
(3)装置E能否不能(填“能”或“不能”)换成装置A,理由是装置A不能吸收空气中的氧气,不能保证反应在无氧环境下进行
(4)TiCl4是制取航天航空工业材料--钛合金的重要原料.某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素.
取少量合金样品于试管中,滴加过量NaOH溶液,振荡,静置后取上层清液,再逐滴滴入稀盐酸至过量,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2.
(5)写出生成TiO2•xH2O的化学方程式TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
(6)检验沉淀是否洗涤干净的方法是取最后一次洗涤液于试管中加入硝酸酸化的AgNO3若没有产生沉淀,则已洗干净.
(7)一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取上述TiO2试样0.2g,消耗0.1mol•L-1 NH4Fe(SO4)2标准溶液20mL
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是:抑制NH4Fe(SO4)2水解.
②该滴定操作所用到的指示剂是KSCN溶液.
③则TiO2质量分数为80%.
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是球形干燥管.
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N2一段时间,④加装药品,⑤点燃酒精灯⑥停止通N2⑦停止加热.正确的操作顺序是②①④③⑤⑦⑥
实验结束后欲分离D中的液态混合物,所采用操作的名称是蒸馏(或分馏).
(3)装置E能否不能(填“能”或“不能”)换成装置A,理由是装置A不能吸收空气中的氧气,不能保证反应在无氧环境下进行
(4)TiCl4是制取航天航空工业材料--钛合金的重要原料.某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素.
取少量合金样品于试管中,滴加过量NaOH溶液,振荡,静置后取上层清液,再逐滴滴入稀盐酸至过量,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2.
(5)写出生成TiO2•xH2O的化学方程式TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
(6)检验沉淀是否洗涤干净的方法是取最后一次洗涤液于试管中加入硝酸酸化的AgNO3若没有产生沉淀,则已洗干净.
(7)一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取上述TiO2试样0.2g,消耗0.1mol•L-1 NH4Fe(SO4)2标准溶液20mL
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是:抑制NH4Fe(SO4)2水解.
②该滴定操作所用到的指示剂是KSCN溶液.
③则TiO2质量分数为80%.

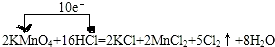 .
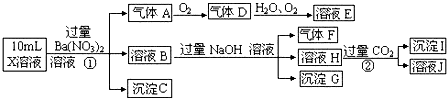
.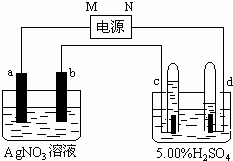 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体.请回答下列问题.
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体.请回答下列问题.