题目内容
2.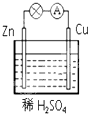 在如图所示的锌铜原电池中,Zn作原电池的负极,电极上发生的是氧化反应(填“氧化”或“还原”),该电极反应式为Zn-2e-=Zn2+,观察到的现象为锌片溶解;Cu作原电池的正 极,电极上发生的是还原反应(填“氧化”或“还原”),该电极反应式为2H++2e-=H2↑,观察到的现象为铜片上有气泡产生.
在如图所示的锌铜原电池中,Zn作原电池的负极,电极上发生的是氧化反应(填“氧化”或“还原”),该电极反应式为Zn-2e-=Zn2+,观察到的现象为锌片溶解;Cu作原电池的正 极,电极上发生的是还原反应(填“氧化”或“还原”),该电极反应式为2H++2e-=H2↑,观察到的现象为铜片上有气泡产生.
分析 铜、锌、稀硫酸溶液构成原电池中,易失电子的锌作负极,铜作正极,负极上发生失电子的氧化反应,正极上得电子发生还原反应,据此分析判断.
解答 解:铜、锌、稀硫酸溶液构成原电池中,易失电子的锌作负极,负极上发生失电子的氧化反应:Zn-2e-=Zn2+,锌片上观察到的现象为锌片溶解;铜作正极,正极上得电子发生还原反应,即H+得电子放出氢气,反应式为 2H++2e-=H2↑,现象是铜片上有气泡产生;
故答案为:负;氧化;Zn-2e-=Zn2+;锌片溶解; 正;还原;2H++2e-=H2↑;铜片上有气泡产生.
点评 本题考查学生原电池的工作原理、电极反应式的书写等知识,难度中等.

练习册系列答案
相关题目
7.下列有关说法正确的是( )
| A. | 分离碘单质和四氯化碳的混合物需要烧杯、玻璃棒和漏斗 | |
| B. | 用湿润的pH试纸测定溶液的pH一定会产生误差 | |
| C. | 实验室可以向浓硫酸中滴加浓盐酸制取少量氯化氢 | |
| D. | 用浓氨水可以除去试管内壁银镜 |
11.以下说法正确的是( )
| A. | mg的CO和H2混合气体充分燃烧后,生成的气体通入Na2O2固体中,固体质量增重mg | |
| B. | 将一定量的CO2气体通入足量的Na2O2固体中,固体量增重2.8g,则反应中有0.1mol电子转移 | |
| C. | 相同质量的铝分别与足量的盐酸和NaOH溶液反应,生成气体物质的量之比为1:3 | |
| D. | NaAlO2溶液中逐滴滴入盐酸至过量,生成的沉淀随着加入的元素所发生的变化如图所示: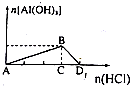 |
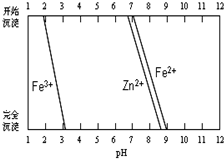 铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为: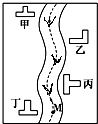 在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示).它们所排出的废液里每厂只含有NaHCO3、FeCl3、Ca(OH)2、HCl中的一种.某环保小组对河水监测时发现
在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示).它们所排出的废液里每厂只含有NaHCO3、FeCl3、Ca(OH)2、HCl中的一种.某环保小组对河水监测时发现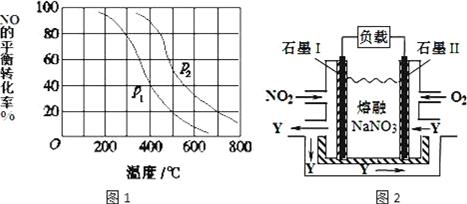
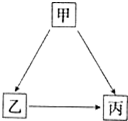 甲、乙、丙三种物质有如图所示的转化关系.
甲、乙、丙三种物质有如图所示的转化关系.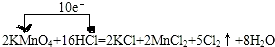 .
.