题目内容
8.NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1 molNa2O2固体中含离子总数为4NA | |
| C. | 1mol羟基与17gNH3所含电子数之比为9:10 | |
| D. | 1molNa2CO3晶体中含CO32-离子数小于NA |
分析 A.根据阳极Cu-2e═Cu2+,电解精炼铜时阳极为粗铜来分析;
B.过氧化钠化学式是由1个过氧根离子和2个钠离子构成,所以其阴阳离子个数之比为1:2,据此计算离子总数;
C.根据羟基中有单电子及中性微粒中质子数等于电子数来分析;
D.1molNa2CO3中含有1molCO32-,CO32-离子数于等NA.
解答 解:A.由Cu-2e═Cu2+,每转移NA个电子时,阳极溶解铜的质量为0.5mol×64g/mol=32g,但阳极材料为粗铜,则阳极溶解铜的质量小于32g,故A错误;
B.过氧化钠化学式是由1个过氧根离子和2个钠离子构成,所以其阴阳离子个数之比为1:2,则1molNa2O2固体中含有离子总数为3NA,故B错误;
C.1mol羟基(-OH)中含有9mol电子,17gNH3所含电子为10mol,电子数之比为9:10,故C正确;
D.1molNa2CO3中含有1mol CO32-,CO32-离子数于等NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,D为易错点,晶体中CO32-不能发生水解,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
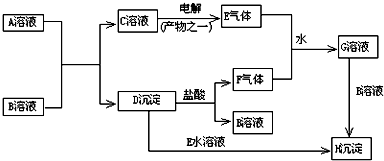
15.某无色溶液中可能含有①Na+②Ba2+③Cl-④Br -⑤S042-⑥SO32-中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
下列结论正确的是( )
| 步驟序号 | 操作步骤 | 现 象 |
| (1) | 用pH试纸检验 | 溶液的pH>7 |
| (2) | 向溶液中滴加氯水,再加人CC14、振荡、静置 | 下层呈橙色 |
| (3) | 向(2)所得水溶液中加人Ba(N03)2溶液和 稀 HNO3 | 有白色沉淀产生 |
| (4) | 过滤,向滤液中加人AgNO3溶液和稀HNO, | 有白色沉淀产生 |
| A. | 不能确定的离子是① | B. | 不能确定的离子是②③ | ||
| C. | 肯定含有的离子是①④⑥ | D. | 肯定没有的离子是②⑤ |
16.在 分子中,在同一平面内的碳原子最多有( )
分子中,在同一平面内的碳原子最多有( )
 分子中,在同一平面内的碳原子最多有( )
分子中,在同一平面内的碳原子最多有( )| A. | 7个 | B. | 8个 | C. | 9个 | D. | 6个 |
20.在NaCl溶液中含有少量的Na2S,欲将S2-除去,可加入( )
| A. | 稀硫酸 | B. | AgCl | C. | NaOH | D. | Ag2S |
17. 阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种历史悠久的解热镇痛药.下列有关说法正确的是( )
阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种历史悠久的解热镇痛药.下列有关说法正确的是( )
 阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种历史悠久的解热镇痛药.下列有关说法正确的是( )
阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种历史悠久的解热镇痛药.下列有关说法正确的是( )| A. | 与乙酰水杨酸具有相同官能团的芳香族同分异构体共有8种(不考虑立体异构) | |
| B. | 乙酰水杨酸的所有原子均在同一平面上 | |
| C. | 乙酰水杨酸能发生取代、加成、氧化、还原反应 | |
| D. | 乙酰水杨酸易溶于水、乙醇等溶剂 |
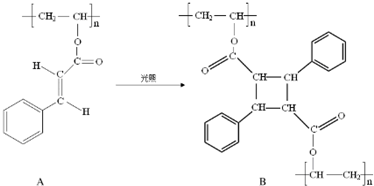
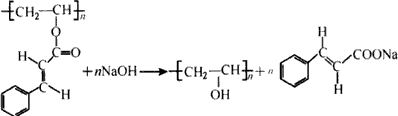 .
.