题目内容
15.某无色溶液中可能含有①Na+②Ba2+③Cl-④Br -⑤S042-⑥SO32-中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:| 步驟序号 | 操作步骤 | 现 象 |
| (1) | 用pH试纸检验 | 溶液的pH>7 |
| (2) | 向溶液中滴加氯水,再加人CC14、振荡、静置 | 下层呈橙色 |
| (3) | 向(2)所得水溶液中加人Ba(N03)2溶液和 稀 HNO3 | 有白色沉淀产生 |
| (4) | 过滤,向滤液中加人AgNO3溶液和稀HNO, | 有白色沉淀产生 |
| A. | 不能确定的离子是① | B. | 不能确定的离子是②③ | ||
| C. | 肯定含有的离子是①④⑥ | D. | 肯定没有的离子是②⑤ |
分析 (1)用pH试纸检验溶液的pH大于7,说明溶液呈碱性,应含有弱酸的酸根离子;
(2)向溶液中滴加氯水,再加入CCl4振荡,静置CCl4层呈橙色,说明溶液中含有Br-;
(3)向所得水溶液中加入Ba(NO3)2溶液和稀HNO3有白色沉淀产生,该沉淀为BaSO4,但不能确定是否含有SO42-,因SO32-可被硝酸氧化生成SO42-;
(4)过滤,向滤液中加入AgNO3溶液和稀HNO3有白色沉淀产生,该沉淀为AgCl,但不能确定溶液中是否含有Cl-,因所加氯水中含有Cl-.
解答 解:(1)用pH试纸检验溶液的pH大于7,说明溶液呈碱性,应含有弱酸的酸根离子,该离子只能为SO32-,则溶液中一定不存在Ba2+,因二者能生成沉淀而不能大量共存,
一定含有Na+,根据溶液呈电中性原则,阳离子只有Na+;
(2)向溶液中滴加氯水,再加入CCl4振荡,静置CCl4层呈橙色,说明溶液中含有Br-;
(3)向所得水溶液中加入Ba(NO3)2溶液和稀HNO3有白色沉淀产生,该沉淀为BaSO4,但不能确定是否含有SO42-,因SO32-可被硝酸氧化生成SO42-;
(4)过滤,向滤液中加入AgNO3溶液和稀HNO3有白色沉淀产生,该沉淀为AgCl,但不能确定溶液中是否含有Cl-,因所加氯水中含有Cl-.
由以上分析可知,溶液中一定含有的离子为①④⑥,可能含有的离子为③⑤,一定不存在的是②.
故选C.
点评 本题考查离子反应及离子组成分的判断,题目难度不大,本题注意把握离子的性质及离子共存问题.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
5.下列设计的实验方案能达到实验目的是( )
| A. | 用新制Cu(OH)2悬浊液检验乙醛:向10ml10%的硫酸铜溶液中加的2%NaOH溶液4-6滴,振荡后加入乙醛溶液0.5ml,加热 | |
| B. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 | |
| C. | 向盛有过量苯酚浓溶液的试管里逐滴加入稀溴水,边加边振荡,观察三溴苯酚的生成 | |
| D. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和氢氧化钠溶液,振荡后静置分液,并除去有机层的水 |
6. 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
Ⅰ.实验原理:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
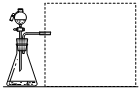
Ⅱ.实验设计(1)【方案一】测量气体产物:在相同温度下,利用右图装置,测定不同浓度H2C2O4溶液与KMnO4反应产生相同体积CO2所需的时间(忽略CO2溶解性的影响).
上图方框中应选择①②④⑤⑥(填编号)仪器组装量气装置,限选以下仪器:①广口瓶、②双孔塞、③水槽、④橡胶管、⑤导管、⑥量筒.
(2)【方案二】观察反应现象:在其它相同条件下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间.拟定实验数据:表中①、②处的数据
分别是5.0、25.
Ⅲ.讨论与交流:(3)实验室常用KMnO4标准溶液滴定某浓度草酸.KMnO4溶液置于酸式
酸式滴定管(填“酸式”或“碱式”)中,判断到达滴定终点的现象
是当滴入最后一滴KMnO4溶液时,溶液由无色变为浅紫红色,且半分钟内不褪色.若读取滴定管数据时,起始读数正确,终点俯视读数,则测定结果偏低(填“偏高”、“偏低”、“无影响”).
 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.Ⅰ.实验原理:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
Ⅱ.实验设计(1)【方案一】测量气体产物:在相同温度下,利用右图装置,测定不同浓度H2C2O4溶液与KMnO4反应产生相同体积CO2所需的时间(忽略CO2溶解性的影响).
上图方框中应选择①②④⑤⑥(填编号)仪器组装量气装置,限选以下仪器:①广口瓶、②双孔塞、③水槽、④橡胶管、⑤导管、⑥量筒.
(2)【方案二】观察反应现象:在其它相同条件下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4溶液混合后,溶液褪色所需的时间.拟定实验数据:表中①、②处的数据
| 实验序号 | 温度/℃ | 各物质的体积/mL | 反应时间 | |||
| H2O | 3mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | 25 | ① | 2.0 | 4.0 | 4.0 | t2 |
| 3 | ② | 7.0 | 2.0 | 4.0 | 2.0 | t3 |
Ⅲ.讨论与交流:(3)实验室常用KMnO4标准溶液滴定某浓度草酸.KMnO4溶液置于酸式
酸式滴定管(填“酸式”或“碱式”)中,判断到达滴定终点的现象
是当滴入最后一滴KMnO4溶液时,溶液由无色变为浅紫红色,且半分钟内不褪色.若读取滴定管数据时,起始读数正确,终点俯视读数,则测定结果偏低(填“偏高”、“偏低”、“无影响”).
3.琥珀酸与乙醇反应生成琥珀酸二乙酯(结构如图所示),下列有关说法正确的是( )
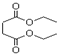

| A. | 1mol琥珀酸二乙酯能与4mol的NaOH反应 | |
| B. | 琥珀酸二乙酯在一定条件下能发生取代、加成和氧化反应 | |
| C. | 琥珀酸的分子式为C4H8O4 | |
| D. | 琥珀酸分子中含有六元环 |
10.中国女药学家屠呦呦因研制新型抗疟药青蒿素和双氢青蒿素成果而获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示:下列关于青蒿素和双氢青蒿素的说法不正确的( )
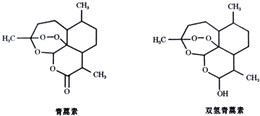

| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素和双氢青蒿素不是同分异构体 | |
| C. | 青蒿素和双氢青蒿素都能发生酯化反应 | |
| D. | 青蒿素在稀硫酸催化条件下能发生水解反应 |
20.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 78 g Na2O2中存在的共价键总数为NA | |
| B. | 0.1 mol${\;}_{38}^{90}$Sr原子中含中子数为3.8NA | |
| C. | 氢氧燃料电池负极消耗2.24 L气体时,电路中转移的电子数为0.1NA | |
| D. | 0.1 mol氯化铁溶于1L水中,所得溶液中Fe3+的数目为0.1NA |
7.用NA表示阿伏加德罗常数的数值,下列说法中不正确的是( )
| A. | 常温下,1L pH=3的硫酸溶液中,SO42-离子的数目约为5×10-4NA | |
| B. | 1mol氨基(NH2)中含有电子的数目为10NA | |
| C. | 一定条件下,1molN2与3molH2充分反应,转移电子的数目可能为2NA | |
| D. | 3molNO2和H2O完全反应,被还原的NO2分子数目为1NA |
4.下列过程中,一定需要通电才能实现的是( )
| A. | 电解质电离 | B. | 电化学防腐 | C. | 蓄电池放电 | D. | 电解精炼铜 |
8.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1 molNa2O2固体中含离子总数为4NA | |
| C. | 1mol羟基与17gNH3所含电子数之比为9:10 | |
| D. | 1molNa2CO3晶体中含CO32-离子数小于NA |