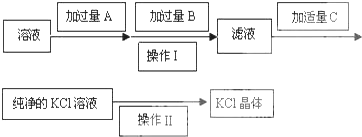
题目内容
13.将某核素AZ X的氯化物${\;}_{Z}^{A}$X35Cl21.10g配成溶液后,需用1mol•Lˉ1的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:(1)X的质量数;
(2)若X的核内中子数为20,求55.0g X${\;}_{17}^{35}$Cl2中所含中子的物质的量.
分析 (1)利用Cl-+Ag+═AgCl↓来计算Cl-的物质的量,从而得出氯化物的物质的量,再利用M=$\frac{m}{n}$及摩尔质量与相对分子质量的数值相等来计算;
(2)利用中子数+质子数=质量数,n=$\frac{m}{M}$及分子的构成、原子的构成来分析.
解答 解:(1)硝酸银的物质的量为0.02L×1mol•L-1=0.02mol,即银离子的物质的量为0.02mol,
由Cl-+Ag+═AgCl↓可知,硝酸银溶液20mL能把氯离子完全沉淀下来,
则Cl-的物质的量为0.02mol,
XCl2的物质的量为0.01mol,
则XCl2的摩尔质量为$\frac{1.10g}{0.01mol}$=110g/mol,
其相对分子质量为110,则X的质量数为110-35×2=40,
答:X的质量数为40;
(2)55g X1735Cl2中所含质子的物质的量为$\frac{55g}{110g/mol}$×(20+18×2)=28mol,
答:55.0g X${\;}_{17}^{35}$Cl2中所含中子的物质的量为28mol.
点评 本题考查学生利用离子反应、质量与物质的量的关系、原子中的数量关系来计算,难度不大,注重对基础知识的考查和训练.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.琥珀酸与乙醇反应生成琥珀酸二乙酯(结构如图所示),下列有关说法正确的是( )


| A. | 1mol琥珀酸二乙酯能与4mol的NaOH反应 | |
| B. | 琥珀酸二乙酯在一定条件下能发生取代、加成和氧化反应 | |
| C. | 琥珀酸的分子式为C4H8O4 | |
| D. | 琥珀酸分子中含有六元环 |
4.下列过程中,一定需要通电才能实现的是( )
| A. | 电解质电离 | B. | 电化学防腐 | C. | 蓄电池放电 | D. | 电解精炼铜 |
8.下列说法正确的是( )
| A. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| B. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| C. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用NaOH溶液除去 | |
| D. | 苯、油脂均不能使酸性KMnO4溶液褪色 |
8.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1 molNa2O2固体中含离子总数为4NA | |
| C. | 1mol羟基与17gNH3所含电子数之比为9:10 | |
| D. | 1molNa2CO3晶体中含CO32-离子数小于NA |
 某原电池的装置如图所示,看到a极上有红色金属析出,回答下列问题:
某原电池的装置如图所示,看到a极上有红色金属析出,回答下列问题:
 .
.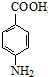 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$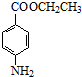 +H2O
+H2O (其中一种)(任写一种)
(其中一种)(任写一种) )的合成路线图(其他原料任选).
)的合成路线图(其他原料任选).