题目内容
11.工业上可用甲烷和氧气在200℃和10MPa的条件下,通过铜制管道反应制得甲醇:2CH4+O2═2CH3COH.(1)已知一定条件下,CH4和CH3COH燃烧的热化学方程式分别为:
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ/lmol
CH3COH(g)+l.5O2(g)═CO2(g)+2H2O(g )△H=-677kJ/mol
则2CH4(g)+O2(g)═2CH3OH(g)△H=-250kJ/mol
(2)甲烷固体氧化物燃料电池属于第三代燃料电池,是一种在高温下直接将储存在燃料和氧化剂中的化学能高效、环境友好地转化成电能的全固态化学发电装置.其工作原理如图1所示.①a是电池的正极(填“正”或“负”),②b极的电极反应式为CH4+4O2-8e-=CO2+2H2O.
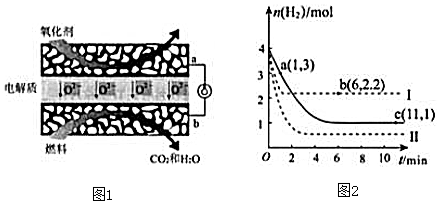
(3)工业上合成甲醇的另一种方法为:CO(g)+2H2(g)?CH3OH(g)△H=-90kJ/mol
T℃时,将2mol CO 和4molH2充入1L 的密闭容器中,测得H2的物质的量随时间变化如图2实线所示.
①能用于判断反应已达化学平衡状态的是AB.
A.气体的总压强不再改变
B.H2与CH3OH的体积比不再改变
C.气体的密度不再改变
D.单位时间内消耗lmol CO,同时生成lmol CH3OH
②请计算出T℃时反应的平衡常数K=3(mol/L)2.
③仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图2中虚线所示.曲线Ⅰ对应的实验条件改变是:升高温度;曲线Ⅱ对应的实验条件改变是增大压强(或增大CO的浓度) 0.
④a、b、c三点逆反应速率由大到小排列的顺序是b>c>a.
分析 (1)①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ/lmol
②CH3COH(g)+l.5O2(g)═CO2(g)+2H2O(g)△H=-677kJ/mol
结合盖斯定律计算(①-②)×$\frac{1}{2}$得到热化学方程式;
(2)原电池中负极上是燃料失电子发生氧化反应,正极上是氧气得到电子发生还原反应;
(3)①CO(g)+2H2(g)?CH3OH(g)△H=-90KJ/mol,反应是气体体积减小的放热反应,化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断;
②利用三段式列式计算出各组分的浓度,再利用平衡常数表达式计算出该反应的平衡常数;
③由图1可知,曲线Ⅰ最先到达平衡,平衡时氢气的物质的量增大,故改变条件应增大反应速率且平衡向逆反应移动;曲线Ⅱ到达平衡的时间比原平衡短,平衡时氢气的物质的量减小,故改变条件应增大反应速率且平衡向正反应移动;结合反应的特征进行分析;
④先拐先平温度高或压强大,反应速率大;
解答 解:(1)①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ/lmol
②CH3COH(g)+l.5O2(g)═CO2(g)+2H2O(g)△H=-677kJ/mol
结合盖斯定律计算(①-②)×$\frac{1}{2}$得到热化学方程式:2CH4(g)+O2(g)═2CH3OH(g)△H=-250KJ/mol
故答案为:-250KJ/mol;
(2)原电池中负极上是燃料失电子发生氧化反应,正极上是氧气得到电子发生还原反应,a为正极,b为负极,电极反应式为CH4+4O2-8e-=CO2+2H2O,
故答案为:正;CH4+4O2-8e-=CO2+2H2O;
(3)①CO(g)+2H2(g)?CH3OH(g)△H=-90KJ/mol,
A.反应前后气体物质的量变化,当气体的总压强不再改变,说明反应达到平衡状态,故A正确;
B.H2与CH3OH的体积比不再改变,说明正逆反应速率相同,故B正确;
C.反应前后气体质量和体积不变,气体密度始终不变,气体的密度不再改变不能说明反应达到平衡状态,故C错误;
D.单位时间内消耗lmol CO,同时生成lmol CH3OH,反应正向进行,故D错误
故答案为:AB;
②CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 2 4 0
变化量(mol/L) 1.5 3 1.5
平衡量(mol/L) 0.5 1 1.5
K=$\frac{1.5}{0.5×{1}^{3}}$(mol/L)2=3(mol/L)2 ,
故答案为:3(mol/L)2;
③对于可逆反应CO(g)+2H2(g)?CH3OH(g)△H=-90KJ/mol,正反应是体积减小的放热反应;由图1可知,曲线Ⅰ最先到达平衡,平衡时氢气的物质的量增大,故改变条件应增大反应速率且平衡向逆反应移动,可以采取的措施为:升高温度;曲线Ⅱ到达平衡的时间比原平衡短,平衡时氢气的物质的量减小,故改变条件应增大反应速率且平衡向正反应移动,可以采取的措施为:增大压强或者是增大CO2浓度,
故答案为:升高温度;增大压强(或增大CO的浓度);
④图象分析可知,先拐先平温度高或压强大,反应速率大,a、b、c三点逆反应速率由大到小排列的顺序是:b>c>a,
故答案为:b>c>a;
点评 本题考查热化学方程式书写、化学平衡图象、反应速率大小判断、外界条件对平衡的影响等,题目难度不大,注意图象1中利用“先拐先平”,即曲线先折拐的首先达到平衡,以此判断温度或压强的高低,再依据外界条件对平衡的影响解答.

 华东师大版一课一练系列答案
华东师大版一课一练系列答案| A. | NH5中N元素的化合价是+5价 | |
| B. | 1molNH5中含有5NA个N-H键 | |
| C. | NH5的电子式为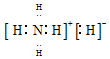 | |
| D. | NH5只由两种非金属元素组成,所以它是共价化合物 |
| A. | 氮分子的结构式:N-N | B. | H2O2的电子式: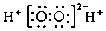 | ||
| C. | 14C的原子结构示意图: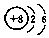 | D. | 钙离子的电子式:Ca2+ |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硝酸银溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| B | 向某溶液中滴加CCl4,振荡静置 | 下层溶液显紫色 | 原溶液中含有I- |
| C | 向25mL沸水中分别滴入5~6滴FeCl3饱和溶液,继续煮沸至出现红褐色沉淀,用激光笔照射 | 形成一条光亮通路 | 制得Fe(OH)3胶体 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液颜色变浅 | Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 滴加甲基橙显红色的溶液中:Na+、K+、Cl-、ClO- | |
| B. | 滴入KSCN显血红色的溶液中:Na+、Mg2+、SO42-、Br- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1012mol/L的溶液中:K+、Na+、NO3-、HCO3- | |
| D. | 由水电离的c(H+)=1.0×10-13mol/L的溶液中:NH4+、Fe2+、NO3-、SO42- |
| A. | 工业上常采用电解法冶炼Z单质 | |
| B. | 气态氢化物的稳定性:H2X>H2M | |
| C. | 离子半径由大到小:M2->Y+>Z3+>X2- | |
| D. | X、Y形成的化合物中阳离子、阴离子个数比一定是2:1 |
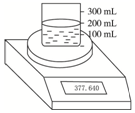 如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:
如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:| 实验操作 | 时间/s | 电子天平读数/g |
| 烧杯+水 | 370.000 | |
| 烧杯+水+样品 | 0 | 377.640 |
| 30 | 376.920 | |
| 60 | 376.400 | |
| 90 | 376.200 | |
| 120 | 376.200 |
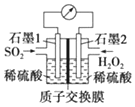 正确认识和使用电池有利于我们每一个人的日常生活.电化学处理 SO2 是目前 研究的热点,利用双氧水氧化吸收 SO2 是目前研究的热点.
正确认识和使用电池有利于我们每一个人的日常生活.电化学处理 SO2 是目前 研究的热点,利用双氧水氧化吸收 SO2 是目前研究的热点.