题目内容
1.水溶液中能大量共存的一组离子是( )| A. | K+、Ca2+、OH-、HCO3- | B. | Fe2+、H+、CO32-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、SCN- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能结合生成络离子,不能发生相互促进水解反应等,则离子大量共存,以此来解答.
解答 解:A.Ca2+、OH-、HCO3-结合生成水和沉淀,不能共存,故A不选;
B.H+、CO32-结合生成水和气体,Fe2+、CO32-相互促进水解,不能共存,故B不选;
C.该组离子之间不反应,可大量共存,故C选;
D.Fe3+、SCN-结合生成络离子,不能共存,故D不选;
故选C.
点评 本题考查离子共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
19.713N是常用于医学PET显像的一种核素,这里的“7”是指该原子的( )
| A. | 质子数 | B. | 中子数 | C. | 质量数 | D. | 原子个数 |
12.足量的镁与一定量的盐酸反应,减慢反应速度,但又不影响产生H2的量,可以加入的物质是( )
| A. | Al | B. | NaOH | C. | K2CO3 | D. | CH3COONa |
9.能说明非金属性Cl>S的是( )
①达到稳定结构时,氯原子只需要1个电子,而硫原子需要2个电子
②氯的含氧酸比硫的含氧酸的酸性强③还原性S2->Cl-
④稳定性HCl>H2S⑤酸性HCl>H2S⑥H2S+Cl2=S↓+2HCl
⑦Cl2与H2在光照或点燃下反应,而硫与H2加热下才反应.
①达到稳定结构时,氯原子只需要1个电子,而硫原子需要2个电子
②氯的含氧酸比硫的含氧酸的酸性强③还原性S2->Cl-
④稳定性HCl>H2S⑤酸性HCl>H2S⑥H2S+Cl2=S↓+2HCl
⑦Cl2与H2在光照或点燃下反应,而硫与H2加热下才反应.
| A. | ②③④⑥ | B. | ③④⑥⑦ | C. | ③④⑤⑥ | D. | 全部 |
16.某烃经催化加氢后,得到2-甲基戊烷,该烃可能的正确名称是( )
| A. | 2-甲基-3-戊炔 | B. | 4-甲基-1,3-戊二烯 | ||
| C. | 2-甲基-2-戊炔 | D. | 2-甲基-3-戊炔 |
6.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硝酸银溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| B | 向某溶液中滴加CCl4,振荡静置 | 下层溶液显紫色 | 原溶液中含有I- |
| C | 向25mL沸水中分别滴入5~6滴FeCl3饱和溶液,继续煮沸至出现红褐色沉淀,用激光笔照射 | 形成一条光亮通路 | 制得Fe(OH)3胶体 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液颜色变浅 | Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
13.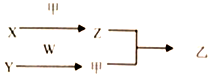 短周期元素A、B、C、D的原子序数依次增加.X、Y、Z、W分別是由这四种元素中的两种组成的常见化合物,甲为单质,乙为红棕色气体,Y为淡黄色固体.上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中正确的是( )
短周期元素A、B、C、D的原子序数依次增加.X、Y、Z、W分別是由这四种元素中的两种组成的常见化合物,甲为单质,乙为红棕色气体,Y为淡黄色固体.上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中正确的是( )
 短周期元素A、B、C、D的原子序数依次增加.X、Y、Z、W分別是由这四种元素中的两种组成的常见化合物,甲为单质,乙为红棕色气体,Y为淡黄色固体.上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中正确的是( )
短周期元素A、B、C、D的原子序数依次增加.X、Y、Z、W分別是由这四种元素中的两种组成的常见化合物,甲为单质,乙为红棕色气体,Y为淡黄色固体.上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中正确的是( )| A. | 原子半径:D>C>B>A | |
| B. | C、D的氢化物均为共价化合物 | |
| C. | 相对分子质量W>X,沸点W>X | |
| D. | B的氢化物常温下一定为气态,C的氢化物常温下为液态 |
10.用 ${\;}_{30}^{70}$Zn 高能原子轰击 ${\;}_{82}^{208}$Pb 的靶子,使锌核与铅核熔合,生成一个 112 号元素原子的同时向外释放出一个中子.下列说法错误的是( )
| A. | 此反应不属于化学变化 | |
| B. | 112 号元素的相对原子质量为 227 | |
| C. | 科学家合成的 112 号元素的原子的中子数为 165 | |
| D. | 112 号元素属于第七周期元素 |
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.