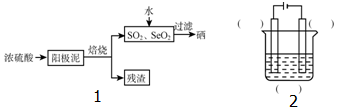
题目内容
6.88.5gNa和K混合物投入水中,完全反应后将气体还原氧化铜,反应后称量固体质量减轻24g,求钠和钾的物质的量之比.分析 设Na和K,分别为xmol和ymol,则23x+39y=88.5①,又知2Na~H2,2K~H2,故生成H2的物质的量为$\frac{1}{2}$(x+y),并根据H2+CuO=Cu+H2O~△m=16g,中氢气的量得出另外一个关系式16(x+y)=24②,据此进行分析.
解答 解:设Na和K,分别为xmol和ymol,则23x+39y=88.5①,又知2Na~H2,2K~H2,故生成H2的物质的量为$\frac{1}{2}$(x+y),
H2+CuO=Cu+H2O△m
1 16
$\frac{1}{2}$(x+y) 24
则:16×$\frac{1}{2}$(x+y)=24②,联立①②解得x=$\frac{57}{32}$mol,y=$\frac{39}{32}$mol,
则x:y=19:13.
答:钠和钾的物质的量之比为19:13.
点评 本题比较简单,正确书写化学方程式是本题解题的关键,固体减少的质量即为氧元素的质量.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
6.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硝酸银溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| B | 向某溶液中滴加CCl4,振荡静置 | 下层溶液显紫色 | 原溶液中含有I- |
| C | 向25mL沸水中分别滴入5~6滴FeCl3饱和溶液,继续煮沸至出现红褐色沉淀,用激光笔照射 | 形成一条光亮通路 | 制得Fe(OH)3胶体 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液颜色变浅 | Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
7.下列化合物的核磁共振氢谱中出现四组峰的是( )
| A. | 2,2,3,3 四甲基丁烷 | B. | 2,3,4 三甲基戊烷 | ||
| C. | 3,3,4,4 四甲基己烷 | D. | 2,5 二甲基己烷 |
4.下列离子方程式正确的是( )
| A. | 碳酸氢铵溶液与足量氢氧化钠溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-═2Fe2++S↓ | |
| C. | 向Fe(NO3) 2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |
11.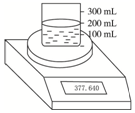 如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:
如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:
试计算样品中的质量分数,并估算最后溶液的pH.
 如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:
如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:| 实验操作 | 时间/s | 电子天平读数/g |
| 烧杯+水 | 370.000 | |
| 烧杯+水+样品 | 0 | 377.640 |
| 30 | 376.920 | |
| 60 | 376.400 | |
| 90 | 376.200 | |
| 120 | 376.200 |
15. 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
已知:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+
(1)进行实验i和ii:
①用化学用语表示饱和Na2SO3溶液pH约为9的原因:SO32-+H2O?HSO3-+OH-.
②用离子方程式解释i中现象:Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H2O.
(2)继续进行实验iii:
为了说明产生上述现象的原因,补充实验:
向2mL蒸馏水中滴加pH=2的0.05mol•L-1 K2Cr2O7橙色溶液3滴,溶液变成浅橙色.
①补充实验的目的是排除水的稀释对溶液颜色变化造成的影响.
②用化学平衡移动原理解释iii中现象:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,溶液中大量的SO32-(或OH-)与H+结合导致溶液中c(H+)下降,平衡正向移动,溶液颜色变黄.
③根据实验i~iii,可推测:Na2SO3溶液和铬(VI)盐溶液的反应与溶液酸碱性有关.
a.碱性条件下,Na2SO3溶液和铬(VI)盐溶液不发生氧化还原反应;
b.酸性条件下,Na2SO3溶液和铬(VI)盐溶液发生氧化还原反应,生成Cr3+.
④向实验iii所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测.该现象是溶液变绿.
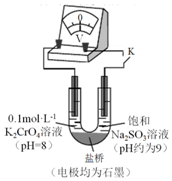
(3)为探究溶液酸性增强对Na2SO3溶液还原性或铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大).
a.K闭合时,电压为x.
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y.
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变.
①上述实验说明:溶液酸性增强,铬(VI)盐溶液的氧化性增强,Na2SO3溶液的还原性几乎没有变化.
②有同学认为:随溶液酸性增强,溶液中O2的氧化性增强也会使电压增大.利用如图装置选择合适试剂进行实验,结果表明O2的存在不影响上述结论.该实验方案是U型管左管中盛放pH=8浓度为0.1mol•L-1K2SO4溶液,右管盛放饱和Na2SO3溶液,闭合K,记录电压;向左管溶液中滴加硫酸至pH=2后,记录电压,测得电压增大了z(z<y).
 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:已知:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+
(1)进行实验i和ii:
| 序号 | 操作 | 现象 |
| i | 向2mL pH=2的0.05mol•L-1 K2Cr2O7橙色溶液中滴加饱和Na2SO3溶液(pH 约为 9)3滴 | 溶液变绿色(含Cr3+) |
| ii | 向2mL pH=8的0.1mol•L-1 K2CrO4黄色溶液中 滴加饱和Na2SO3溶液3滴 | 溶液没有明显变化 |
②用离子方程式解释i中现象:Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H2O.
(2)继续进行实验iii:
| 序号 | 操作 | 现象 |
| iii | 向2mL饱和Na2SO3溶液中滴加pH=2的0.05mol•L-1 K2Cr2O7橙色溶液3滴 | 溶液变黄色 |
向2mL蒸馏水中滴加pH=2的0.05mol•L-1 K2Cr2O7橙色溶液3滴,溶液变成浅橙色.
①补充实验的目的是排除水的稀释对溶液颜色变化造成的影响.
②用化学平衡移动原理解释iii中现象:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,溶液中大量的SO32-(或OH-)与H+结合导致溶液中c(H+)下降,平衡正向移动,溶液颜色变黄.
③根据实验i~iii,可推测:Na2SO3溶液和铬(VI)盐溶液的反应与溶液酸碱性有关.
a.碱性条件下,Na2SO3溶液和铬(VI)盐溶液不发生氧化还原反应;
b.酸性条件下,Na2SO3溶液和铬(VI)盐溶液发生氧化还原反应,生成Cr3+.
④向实验iii所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测.该现象是溶液变绿.
(3)为探究溶液酸性增强对Na2SO3溶液还原性或铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大).
a.K闭合时,电压为x.
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y.
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变.
①上述实验说明:溶液酸性增强,铬(VI)盐溶液的氧化性增强,Na2SO3溶液的还原性几乎没有变化.
②有同学认为:随溶液酸性增强,溶液中O2的氧化性增强也会使电压增大.利用如图装置选择合适试剂进行实验,结果表明O2的存在不影响上述结论.该实验方案是U型管左管中盛放pH=8浓度为0.1mol•L-1K2SO4溶液,右管盛放饱和Na2SO3溶液,闭合K,记录电压;向左管溶液中滴加硫酸至pH=2后,记录电压,测得电压增大了z(z<y).
16.有机物A是某种药物的中间体,其结构简式为: 关于有机物A的说法不正确的是( )
关于有机物A的说法不正确的是( )
 关于有机物A的说法不正确的是( )
关于有机物A的说法不正确的是( )| A. | A的分子式为C16H1403 | |
| B. | A可使酸性KMnO4溶液褪色和溴水褪色 | |
| C. | A苯环上的一氯代物同分异构体有2种 | |
| D. | A既可发生氧化反应和加成反应,又可以发生取代反应 |
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.