题目内容
15.对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的.汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ N2(g)+2CO2(g)+Q(Q>0).一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(2)前2s内的平均反应速率υ(N2)=1.875×10-4mol/(L•s);
达到平衡时,CO的转化率为25%.
(3)下列描述中能说明上述反应已达平衡的是bd
a.2υ正(NO)=υ逆(N2) b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中CO的转化率不再发生变化
(4)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液.往(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,$\frac{c(NH_4^+)}{{c(SO_4^{2-})}}$的值将变大(填“变大”、“不变”或“变小”)
(5)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是②>①>③(填编号);
(6)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀.用电离平衡原理解释上述现象饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀.加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生.
分析 (1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
(2)先计算v(NO),再根据反应速率与计量数关系计算υ(N2);
CO转化率=$\frac{参加反应的CO物质的量浓度}{CO初始物质的量浓度}×100%$;
(3)只有反应前后改变的物理量不变时可逆反应才能达到平衡状态;
(4)在(NH4)2SO4溶液中存在水解反应,2NH4++H2O?NH3•H2O+H+,往(NH4)2SO4溶液中再加入少量 (NH4)2SO4固体,水解平衡向正方向进行,但铵根的水解率减小,所以$\frac{c(NH_4^+)}{{c(SO_4^{2-})}}$的值将变大;
(5)①NH4Cl ②NH4HCO3 ③NH4HSO4,其中③对水的电离起到抑制作用,①②对水的电离起到促进作用,根据水解程度判断对水的电离的影响分析解答;
(6)根据饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀;加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生来分析.
解答 解:(1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,所以K=$\frac{c({N}_{2}).{c}^{2}(C{O}_{2})}{{c}^{2}(CO).{c}^{2}(NO)}$,故答案为:K=$\frac{c({N}_{2}).{c}^{2}(C{O}_{2})}{{c}^{2}(CO).{c}^{2}(NO)}$;
(2)v(NO)=$\frac{(1.00-0.25)×1{0}^{-3}mol/L}{2s}$=3.75×10-4mol/(L•s),再根据反应速率与计量数关系得υ(N2)=1.875×10-4mol/(L•s);
CO转化率=$\frac{参加反应的CO物质的量浓度}{CO初始物质的量浓度}×100%$=$\frac{(3.60-2.70)×1{0}^{-3}mol/L}{3.60×1{0}^{-3}mol/L}$×100%=25%,
故答案为:1.875×10-4;25%;
(3)a.反应速率之比等于化学方程式计量数之比,为正反应速率之比,v正(NO)=2v逆(N2)说明氮气正逆反应速率相同,2v正(NO)=v逆(N2),不能说明反应达到平衡状态,故a错误;
b.反应前后气体质量不变,气体物质的量减小,容器中气体的平均分子量不随时间而变化说明反应达到平衡状态,故b正确;
c.反应 前后气体质量不变,体积不变,过程中和平衡状态容器中气体的密度都不随时间而变化,不能说明反应达到平衡状态,故c错误;
d.容器中CO的转化率不再发生变化,是平衡标志,故d正确;
故答案为:bd;
(4)在(NH4)2SO4溶液中存在水解反应,2NH4++H2O?NH3•H2O+H+,往(NH4)2SO4溶液中再加入少量 (NH4)2SO4固体,水解平衡向正方向进行,但铵根的水解率减小,所以$\frac{c(NH_4^+)}{{c(SO_4^{2-})}}$将变大,故答案为:变大;
(5)物质的量浓度相等的三种铵盐溶液:①NH4Cl②NH4HCO3③NH4HSO4,这三种溶液中,其中③对水的电离起到抑制作用,①②对水的电离起到促进作用,所以三种溶液中由水电离出的OH-浓度③中浓度最小,又②NH4HCO3是互相促进水解水解程度更大,则,②对水的电离起到促进作用比①大,所以三种溶液中水的电离程度由大到小的顺序是②①③,故答案为:②>①>③;
(6)因为饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀,加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生,
故答案为:饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀,而加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生.
点评 本题考查化学平衡计算、盐类水解等知识点,为高频考点,注意盐类水解的实质和把握弱电解质的电离,从影响平衡移动的角度分析水的电离程度,注意:只有反应前后改变的物理量才能作为平衡状态判断依据,题目难度不大.

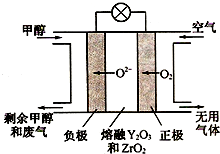 铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H
铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H(1)已知:
①3Fe(s)+2O2(g)?Fe3O4(s)△H 1=-1118.4kJ/mol
②2H2(g)+O2(g)?2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)?2H2O(l)△H3=-571.8kJ/mol
则△H=-150.8KJ/mol(计算结果保留一位小数).
(2)在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按如表所示 加入物质,在t℃时反应经过一段时间后达到平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法正确的是B(填序号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(3)若将(2)中装置改为恒容绝热(不与外界交换能量)的装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
(4)一种以甲醇做燃料的电池示意图如图,写出该电池放电时负极的电极反应式:CH3OH-6e-+3O2-=CO2↑+2H2O.
(1)己知N2O4(g)═2NO2(g)△H=+57.20kJ/mol,t℃时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
②20min时改变的条件是增大二氧化氮浓度;重新达到平衡时,NO2的转化率将b(填选项前字母).
a.增大 b.减小 c.不变 d.无法判断
③t℃时,下列情况不能说明该反应处于平衡状态的是A;
A.混合气体的密度保持不变 B.混合气体的颜色不再变化
C.混合气体的气体压强保持不变 D.N2O4 与NO2的物质的量比为10:3
④若反应在t℃进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时v(正)>v(逆)(填“>”、“<”或“=”).
(2)已知2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225kJ/mol
| 化学键 | N-H | N-N | N≡N | O-H |
| 键能(kJ/mol) | 390 | 190 | 946 | 460 |
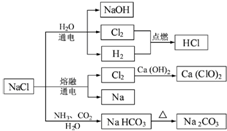
| A. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 图中所示转化反应不都是氧化还原反应 |

 铁是目前人类使用量最大的金属,它能形成多种化合物.
铁是目前人类使用量最大的金属,它能形成多种化合物.