题目内容
3. 铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H
铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H(1)已知:
①3Fe(s)+2O2(g)?Fe3O4(s)△H 1=-1118.4kJ/mol
②2H2(g)+O2(g)?2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)?2H2O(l)△H3=-571.8kJ/mol
则△H=-150.8KJ/mol(计算结果保留一位小数).
(2)在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按如表所示 加入物质,在t℃时反应经过一段时间后达到平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法正确的是B(填序号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(3)若将(2)中装置改为恒容绝热(不与外界交换能量)的装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
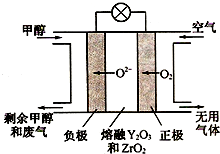
(4)一种以甲醇做燃料的电池示意图如图,写出该电池放电时负极的电极反应式:CH3OH-6e-+3O2-=CO2↑+2H2O.
分析 (1)依据热化学方程式的书写方法,标注物质聚集状态和对应焓变写出,依据盖斯定律计算反应的焓变;
(2)①根据初始的量,利用K的值结合三段式求算;
②可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变;
(3)恒容绝热根据反应时温度变化,判断平衡移动,分析氢气的百分含量;
(4)甲醇燃料在原电池中做负极失电子发生氧化反应.
解答 解:(1)已知:
①3Fe(s)+2O2(g)═Fe3O4(s)△H1=-1118.4kJ/mol
②2H2(g)+O2(g)═2H2O(g)△H2=-483.8kJ/mol
根据盖斯定律可知①-②×2得:
3Fe(s)+4H2O(g)═Fe3O4(s)+4H2(g)△H
△H=△H 1-2△H2=-1118.4kJ/mol+483.8kJ/mol×2=-150.8KJ/mol;
故答案为:-150.8KJ/mol;
(2)①设甲容器中达到平衡时转化的水的物质的量为xmol,
3Fe(s)+4H20(g)?Fe3O4(s)+4H2(g)
起始量(mol):1 1 1 1
转化量(mol):x x
平衡量(mol):1-x 1+x
则K=$\frac{c{\;}^{4}(H{\;}_{2})}{c{\;}^{4}(H{\;}_{2}O)}$=$\frac{(1+x){\;}^{4}}{(1-x){\;}^{4}}$=16,所以x=$\frac{1}{3}$,则甲容器中H2O的平衡转化率为$\frac{\frac{1}{3}}{1}$×100%=33.3%,
故答案为:33.3%;
②A、该反应为气体体积不变的反应,所以容器内压强始终不变,不能用压强判断平衡状态,故A错误;
B、水蒸气的密度与氢气的密度不同,所以当容器内的密度不变时,即是平衡状态,故B正确;
C、设乙中水转化了xmol,则$\frac{(\frac{1+x}{2}){\;}^{4}}{(\frac{1.5-x}{2}){\;}^{4}}$=K=16,则x=0.667,所以乙中水的转化率为$\frac{0.667}{1.5}$×100%=44.4%,所以大于甲中转化率33.3%,故C错误;
D、增加固体的量平衡不移动,所以水的转化率不变,故D错误;
故答案为:B;
(3)由于反应前后气体体积相等,所以C条件下,平衡不移动,氢气的体积分数与平衡是相同;A状况下,反应正向进行生成氢气,反应放出热量使容器温度升高,抑制反应继续生成氢气,故氢气体积分数较低,B状况下反应逆向进行生成Fe和水,是吸热过程,使容器温度降低,抑制反应继续消耗氢气,所以氢气的体积分数较高,故H2的百分含量按由大到小的顺序排列:B>C>A;
故答案为:B>C>A;
(4)依据图示分析,甲醇做负极失电子发生氧化反应,在熔融盐做电解质中发生的电极反应为:CH3OH-6e-+3O2-=CO2↑+2H2O;
故答案为:CH3OH-6e-+3O2-=CO2↑+2H2O.
点评 本题考查了化学平衡常数、盖斯定律、平衡状态的判断、原电池原理等,题目综合性较强,难度较大,侧重于对有关原理应用的考查.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 淀粉溶液遇碘变成蓝色,可用于检验碘单质的存在 | |
| C. | Fe在常温下遇浓硫酸发生钝化,可用铁制容器盛放冷的浓硫酸 | |
| D. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.4 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
| n(H2)(mol) | 1.2 | 1.05 | n1 | n2 | n2 | n2 |
(1)n1=0.93,250℃下,该反应的平衡常数K=13.7;△H=-49kJ/mol.
(2)平衡时CO2的转化率是25%.
(3)能说明反应已达平衡状态的是BC.
A.v(H2)=3v(CO2) B.容器内压强保持不变
C.v逆(CO2)=v正(CH3OH) D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出产物 B.适当升高温度 C.增大CO2浓度 D.选择高效催化剂
(5)“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示,过程中用到生石灰(部分条件及物质未标出).
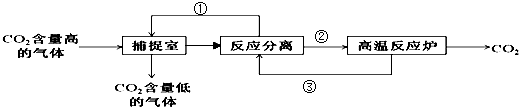
物质①为NaOH,物质③为CaO,操作②为过滤.整个过程发生的化学反应方程式有:2NaOH+CO2=Na2CO3+H2O,CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(2)前2s内的平均反应速率υ(N2)=1.875×10-4mol/(L•s);
达到平衡时,CO的转化率为25%.
(3)下列描述中能说明上述反应已达平衡的是bd
a.2υ正(NO)=υ逆(N2) b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中CO的转化率不再发生变化
(4)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液.往(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,$\frac{c(NH_4^+)}{{c(SO_4^{2-})}}$的值将变大(填“变大”、“不变”或“变小”)
(5)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是②>①>③(填编号);
(6)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀.用电离平衡原理解释上述现象饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀.加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生.
| A. | 苯和乙烯都能使溴水褪色,且反应原理相同 | |
| B. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| C. | 分子式为C10H14 苯环上只有一个取代基的芳香烃,其可能的结构有3种 | |
| D. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
 氢气是一种新型的绿色能源,又是一种重要的化工原料.
氢气是一种新型的绿色能源,又是一种重要的化工原料.