题目内容
14.下列说法正确的是( )| A. | 铝制品的耐腐蚀性强,说明铝的化学性质不活泼 | |
| B. | 化学反应速率的单位由时间单位和物质的量单位决定 | |
| C. | 离子键的本质是静电作用,只能存在于由阴,阳离子构成的物质中 | |
| D. | 可将金属钠在研体中研成粉末,使钠与水反应的实验更安全 |
分析 A、铝表面生成一层致密的氧化物保护膜,阻止内部金属继续被氧化;
B、化学反应速率通常用单位时间内反应物或生成物的物质的量浓度的变化来表示;
C、离子键是阳离子、阴离子之间的静电作用,既有吸引又有排斥作用;
D、根据金属钠的性质来分析.
解答 解:A、铝表面生成一层致密的氧化物保护膜,阻止内部金属继续被氧化,铝是活泼金属,故A错误;
B、化学反应速率通常用单位时间内反应物或生成物的物质的量浓度的变化来表示,故B错误;
C、离子键是阳离子、阴离子之间的静电作用,只能存在于由阴、阳离子构成的物质中,故C正确;
D、金属钠性质比较活泼,在研钵中研成粉末时易于空气中氧气,水反应,故D错误.
故选C.
点评 本题考查铝的活泼性、化学反应速率、离子键的存在和常见的实验基本操作知识,可以根据教材知识来回答,较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.实验室用浓硫酸和乙醇反应制备乙烯,若温度过高或加热时间过长,制得的乙稀往往混有CO2、SO2、H2O(气体少量).请回答下列问题:
(1)试分析CO2和SO2 是怎么样产生的?乙醇或乙烯与浓硫酸发生氧化还原反应生成CO2和SO2(用一句话说明).
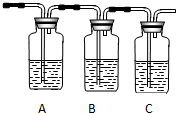
(2)试用如图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),按气流的方向,各装置的连接顺序是:④②①③.
(3)实验时若观察到:①中A瓶中溶液褪色,B瓶中溶液颜色逐渐变浅,C瓶中溶液不褪色,则C瓶的作用是检验SO2是否除尽.
(4)装置②中所加的试剂名称是无水硫酸铜,简述确定装置②在整套装置中的位置的理由是①③导出的气体带有水蒸气,影响水蒸气的确定.
(1)试分析CO2和SO2 是怎么样产生的?乙醇或乙烯与浓硫酸发生氧化还原反应生成CO2和SO2(用一句话说明).
(2)试用如图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),按气流的方向,各装置的连接顺序是:④②①③.
 品红溶液 KMnO4 溶液品红溶液 品红溶液 KMnO4 溶液品红溶液 ① |  ② ② |  ③ |  ④ |
(4)装置②中所加的试剂名称是无水硫酸铜,简述确定装置②在整套装置中的位置的理由是①③导出的气体带有水蒸气,影响水蒸气的确定.
2.下列装置能达到实验目的是( )
| A. |  检验产物中含有乙烯 | B. |  除去CO中混有少量的CO2 | ||
| C. |  验证减压蒸馏原理 | D. |  收集NH3 |
13.下列关于NaOH溶液和氨水的说法正确的是( )
| A. | 相同浓度的两溶液中c(OH-) 相同 | |
| B. | pH=13的两溶液稀释100倍,pH都为11 | |
| C. | 100 mL 0.1 mol/L的两溶液能中和等物质的量的盐酸 | |
| D. | 两溶液中分别加入少量对应的硫酸盐固体,c(OH-) 均明显减小 |
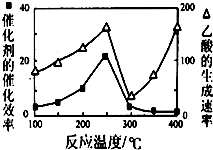 利用CH4和CO2可以制造价值更高的化学产品.已知下列反应:
利用CH4和CO2可以制造价值更高的化学产品.已知下列反应:
 .
.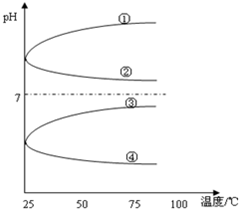 A、B、C、D、E五种溶液分别为NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别为NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验: