题目内容
 (1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.
(1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.①在通常状况下,金刚石和石墨相比较,
②24g石墨在一定量空气中燃烧,生成气体80g,该过程放出的热量为
(2)已知:N2、O2分子中化学键的键能分别是946kJ/mol、497kJ/mol.N2(g)+O2(g)═2NO(g)△H=+180.0kJ/mol.NO分子中化学键的键能为
(3)综合上述有关信息,请写出用CO除去NO的热化学方程式:
(4)通常把拆开1mol化学键所吸收的热量看成该化学键的键能.已知部分化学键的键能如表所示:
| 化学键 | N-H | N-N | O═O | N≡N | O-H |
| 键能(kJ/mol) | 386 | 167 | 498 | 946 | 460 |
考点:反应热和焓变,键能、键长、键角及其应用,热化学方程式
专题:化学反应中的能量变化
分析:(1)①依据物质能量越高,物质越不稳定;依据图象判断石墨的燃烧热;
②依据极值计算判断生成的气体组成,结合热化学方程式计算得到;
(2)据△H=反应物键能和-生成物键能和求算;
(3)利用盖斯定律结合已知热化学方程式计算反应热,再写出热化学方程式;
(4)先写出化学方程式,然后根据焓变=反应物的总键能-生成物的总键能计算焓变.
②依据极值计算判断生成的气体组成,结合热化学方程式计算得到;
(2)据△H=反应物键能和-生成物键能和求算;
(3)利用盖斯定律结合已知热化学方程式计算反应热,再写出热化学方程式;
(4)先写出化学方程式,然后根据焓变=反应物的总键能-生成物的总键能计算焓变.
解答:
解:(1)①图象分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图象分析1mol石墨完全燃烧生成1mol二氧化碳放出的热量为393.5kJ,则石墨的燃烧热为△H=-393.5kJ?mol-1;
故答案为:石墨;-393.5kJ?mol-1;
②24g石墨物质的量为2mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为88g,若生成一氧化碳质量为56g,生成气体80g,56g<80g<88g,判断生成的气体为一氧化碳和二氧化碳气体,设一氧化碳物质的量为x,二氧化碳物质的量为(2-x)mol,28x+44(2-x)=80g,x=0.5mol,二氧化碳物质的量为1.5mol;依据图象分析,C(石墨,s)+O2(g)=CO2(g)△H=-393.5 kJ?mol-1;C(石墨,s)+
O2(g)=CO(g)△H=-110.5 kJ?mol-1,生成二氧化碳和一氧化碳混合气体放出热量=393.5 kJ?mol-1×1.5mol+110.5 kJ?mol-1×0.5mol=645.5kJ,即24g石墨在一定量空气中燃烧,生成气体80g,该过程放出的热量为645.5kJ;
故答案为:645.5KJ;
(2)△H=反应物键能和-生成物键能和,946kJ/mol+497kJ/mol-2Q(N-O)=180.0kJ/mol,Q(N-O)=631.5KJ/mol,故答案为:631.5;
(3)已知①C(石墨,s)+O2(g)=CO2(g)△H=-393.5 kJ?mol-1;
②C(石墨,s)+
O2(g)=CO(g)△H=-110.5 kJ?mol-1;
③N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1;
由盖斯定律:方程式①×2-②×2-③得 2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.0kJ?mol-1;
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.0kJ?mol-1;
(4)N2H4燃烧的化学方程式为N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=反应物的总键能-生成物的总键能=167 kJ?mol-1+386 kJ?mol-1×4+498 kJ?mol-1-946 kJ?mol-1-460 kJ?mol-1×4=-577 kJ?mol-1,所以N2H4燃烧的热化学方程式为N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-577 kJ?mol-1.
故答案为:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-577 kJ?mol-1.
故答案为:石墨;-393.5kJ?mol-1;
②24g石墨物质的量为2mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为88g,若生成一氧化碳质量为56g,生成气体80g,56g<80g<88g,判断生成的气体为一氧化碳和二氧化碳气体,设一氧化碳物质的量为x,二氧化碳物质的量为(2-x)mol,28x+44(2-x)=80g,x=0.5mol,二氧化碳物质的量为1.5mol;依据图象分析,C(石墨,s)+O2(g)=CO2(g)△H=-393.5 kJ?mol-1;C(石墨,s)+
| 1 |
| 2 |
故答案为:645.5KJ;
(2)△H=反应物键能和-生成物键能和,946kJ/mol+497kJ/mol-2Q(N-O)=180.0kJ/mol,Q(N-O)=631.5KJ/mol,故答案为:631.5;
(3)已知①C(石墨,s)+O2(g)=CO2(g)△H=-393.5 kJ?mol-1;
②C(石墨,s)+
| 1 |
| 2 |
③N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1;
由盖斯定律:方程式①×2-②×2-③得 2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.0kJ?mol-1;
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.0kJ?mol-1;
(4)N2H4燃烧的化学方程式为N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=反应物的总键能-生成物的总键能=167 kJ?mol-1+386 kJ?mol-1×4+498 kJ?mol-1-946 kJ?mol-1-460 kJ?mol-1×4=-577 kJ?mol-1,所以N2H4燃烧的热化学方程式为N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-577 kJ?mol-1.
故答案为:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-577 kJ?mol-1.
点评:本题考查了化学反应的能量变化与反应的焓变关系的分析判断,图象的综合应用,读懂图象,焓变和活化能计算方法的理解是解题的关键.

练习册系列答案
相关题目
在一定温度时,将1mol A和2mol B放入容积为5L的某密闭容器中发生如下反应:A(s)+2B(g)?C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol/L.下列叙述不正确的是( )
| A、在5 min 内该反应用C的浓度变化表示的反应速率为0.02 mol/(L?min) |
| B、5 min 时,容器内D的浓度为0.2 mol/L |
| C、该可逆反应随反应的进行,容器内压强逐渐增大 |
| D、5 min时容器内气体总的物质的量为3 mol |
参照反应Br2+H2→HBr+H的能量随反应历程变化的示意图,下列叙述中正确的是( )
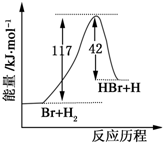

| A、反应物具有的总能量大于生成物具有的总能量 |
| B、正反应为吸热反应 |
| C、逆反应为吸热反应 |
| D、从图中可看出,该反应的反应热与反应途径有关 |
下列关于反应热的说法正确的是( )
①通常情况下,化学反应中能量的转化主要是化学能和热能之间的转化.
②同一化学反应在不同温度下进行,反应热的数值不同.
③反应热通常用Q表示,反应放热时,Q为负值,反应吸热时,Q为正值.
①通常情况下,化学反应中能量的转化主要是化学能和热能之间的转化.
②同一化学反应在不同温度下进行,反应热的数值不同.
③反应热通常用Q表示,反应放热时,Q为负值,反应吸热时,Q为正值.
| A、只有③ | B、只有①② |
| C、只有①③ | D、全部正确 |
一定条件下,向含HNO3的废水中加入CH3OH进行污水处理,发生反应5CH3OH+6HNO3=3N2↑+5CO2↑+13H2O,下列说法正确的是( )
| A、CH3OH被氧化,表现氧化性 |
| B、此条件下还原性强弱为:N2>CH3OH |
| C、若氧化产物比还原产物多0.2mol,则该反应中转移3mol |
| D、该反应过程中断裂的化学键既有极性键又有非极性键 |
M(NO3)2热分解化学方程式为:2M(NO3)2
2MO+4NO2↑+O2↑,加热37.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是( )
| ||
| A、24g/mol |
| B、64g/mol |
| C、65g/mol |
| D、40g/mol |
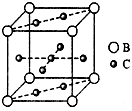 A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kj/mol)分别为:578、1 817、2 745、ll 575;E与F能形成原子数目 比为1:3、熔点为190℃的化合物Q.
A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kj/mol)分别为:578、1 817、2 745、ll 575;E与F能形成原子数目 比为1:3、熔点为190℃的化合物Q.