题目内容
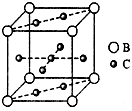 A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kj/mol)分别为:578、1 817、2 745、ll 575;E与F能形成原子数目 比为1:3、熔点为190℃的化合物Q.
A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kj/mol)分别为:578、1 817、2 745、ll 575;E与F能形成原子数目 比为1:3、熔点为190℃的化合物Q.(1)写出A的基态核外电子排布式
(2)C2+和A2+都能与NH3、H20等形成配位数为4的配合物.[A(NH3)4]2+和[C(NH3)4]2+空间构型不同且都具有对称性,则[C(NH3)4]2+的空间构型为
(3)含有D、碳、硫三种元素的负一价离子中,所有原子均满足最外层8电子结构,一个电子是由硫原子所得,则其电子式为
(4)实验测得气态无水Q在1.Ol×105 Pa、t1℃的密度为5.OO g?L-1、气体摩尔体积为53.4L?mol-1,则此时Q的组成为(写化学式)
考点:位置结构性质的相互关系应用,晶胞的计算
专题:
分析:A、B、C、D、E、F六种元素,D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的,则D原子处于第二周期,外围电子排布为2s22p3,故D为氮元素;E、F的原子均有三个能层,E原子的第一电离能至第四电离能(kJ/mol)分别为:578,1817、2745、11575,E的最高价为+3,故E为铝元素;E与F能形成原子数目比为1:3,熔点为190℃的化合物,F为-1价,故F为氯元素,化合物Q熔点低,化合物Q是分子晶体;A、B、C属于第四周期且单质均为固体原子处于基态时,A、B原子核外电子均成对,A、B原子外围电子排布为4s2、3d104s2、4s24p6,且核电荷数A>B,故B为钙元素,A为锌元素;C与A在周期表属于同一区的元素,属于ds区,故C为铜元素.
解答:
解:A、B、C、D、E、F六种元素,D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的,则D原子处于第二周期,外围电子排布为2s22p3,故D为氮元素;E、F的原子均有三个能层,E原子的第一电离能至第四电离能(kJ/mol)分别为:578,1817、2745、11575,E的最高价为+3,故E为铝元素;E与F能形成原子数目比为1:3,熔点为190℃的化合物,F为-1价,故F为氯元素,化合物Q熔点低,化合物Q是分子晶体;A、B、C属于第四周期且单质均为固体原子处于基态时,A、B原子核外电子均成对,A、B原子外围电子排布为4s2、3d104s2、4s24p6,且核电荷数A>B,故B为钙元素,A为锌元素;C与A在周期表属于同一区的元素,属于ds区,故C为铜元素.
故A为锌元素、B为钙元素、C为铜元素、D为氮元素、E为铝元素、F为氯元素.
(1)A为锌元素,A的基态核外电子排布式为1s22s22p63s23p63d104s2;由晶胞结构可知,晶胞中Ca原子数目为8×
=1,Cu原子数目为1+8×
=5,B、C合金的组成为CaCu5;CaCu5的摩尔质量为360g/mol,设该晶胞的边长为x,根据密度公式:ρV=m,aNAx3=360,x=
;
故答案为:1s22s22p63s23p63d104s2;CaCu5;
;
(2)A为锌元素、C为铜元素,[Zn(NH3)4]2+和[Cu(NH3)4]2+都具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,[Cu(NH3)4]2+的空间构型为平面正方形;[Zn(NH3)4]2+中的两个NH3被两个Cl-取代只能得到一种产物;[Zn(NH3)4]2+为正四面体结构,Zn采取sp3杂化,
故答案为:平面正方形;sp3;
(3)D为氮元素,碳、硫三种元素的负一价离子中,所有原子均满足最外层8电子结构,氮原子形成三键,碳原子形成4条共价键,硫原子形成2条共价键,其中一个电子是由硫原子所得,电子式为: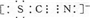 ,
,
故答案为: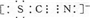 ;
;
(4)实验测得气态无水Q在1.01ⅹ105Pa,t1℃的密度为5.00g/L,气体摩尔体积为53.4L/mol,该化合物的摩尔质量为5.00g/L×53.4L/mol=267g/mol,令化合物Q化学式为(AlCl3)n,所以:n×(27+35.5×3)=267,解得n=2,所以化合物Q化学式为Al2Cl6.
故答案为:Al2Cl6.
故A为锌元素、B为钙元素、C为铜元素、D为氮元素、E为铝元素、F为氯元素.
(1)A为锌元素,A的基态核外电子排布式为1s22s22p63s23p63d104s2;由晶胞结构可知,晶胞中Ca原子数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 3 |
| ||
故答案为:1s22s22p63s23p63d104s2;CaCu5;
| 3 |
| ||
(2)A为锌元素、C为铜元素,[Zn(NH3)4]2+和[Cu(NH3)4]2+都具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代能得到两种不同结构的产物,[Cu(NH3)4]2+的空间构型为平面正方形;[Zn(NH3)4]2+中的两个NH3被两个Cl-取代只能得到一种产物;[Zn(NH3)4]2+为正四面体结构,Zn采取sp3杂化,
故答案为:平面正方形;sp3;
(3)D为氮元素,碳、硫三种元素的负一价离子中,所有原子均满足最外层8电子结构,氮原子形成三键,碳原子形成4条共价键,硫原子形成2条共价键,其中一个电子是由硫原子所得,电子式为:
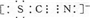 ,
,故答案为:
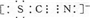 ;
;(4)实验测得气态无水Q在1.01ⅹ105Pa,t1℃的密度为5.00g/L,气体摩尔体积为53.4L/mol,该化合物的摩尔质量为5.00g/L×53.4L/mol=267g/mol,令化合物Q化学式为(AlCl3)n,所以:n×(27+35.5×3)=267,解得n=2,所以化合物Q化学式为Al2Cl6.
故答案为:Al2Cl6.
点评:本题考查核外电子排布规律、原子结构与物质关系、晶体结构与化学键等,难度中等,根据核外电子排布推断元素是关键,是对知识的综合考查.

练习册系列答案
相关题目
用Pt电极放置于KOH溶液中,然后分别向两极通入CO和O2,即可产生电流,下列叙述中正确的是( )
①通入CO的电极为阴极
②通入CO的电极反应式为:2CO+O2+4e-═2CO2
③正极电极反应式为:O2+2H2O+4e-═4OH-
④负极电极反应式为:CO+4OH--2e-═CO32-+2H2O
⑤电池工作时溶液中的阳离子向原电池的负极移动
⑥放电时溶液中的阴离子向负极移动.
①通入CO的电极为阴极
②通入CO的电极反应式为:2CO+O2+4e-═2CO2
③正极电极反应式为:O2+2H2O+4e-═4OH-
④负极电极反应式为:CO+4OH--2e-═CO32-+2H2O
⑤电池工作时溶液中的阳离子向原电池的负极移动
⑥放电时溶液中的阴离子向负极移动.
| A、①④⑥ | B、③④⑥ |
| C、④⑤⑥ | D、①②③ |
下列实验操作中错误的是( )
| A、进行蒸发操作时,当有大量晶体析出,就应停止加热 |
| B、进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、进行萃取操作时,应选择有机萃取剂,如可用酒精萃取溴水中的溴 |
如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )
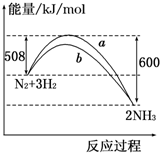

| A、该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ/mol |
| B、a曲线是加入催化剂时的能量变化曲线 |
| C、加入催化剂,该化学反应的反应热改变 |
| D、在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>Q |
一定温度下,对于反应N2+O2?2NO在密闭容器中进行,下列措施一定能加快反应速率的是( )
| A、使压强增大 |
| B、恒容,充入N2 |
| C、恒容,充入He气 |
| D、恒压,充入He气 |
 (1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.
(1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示. 掌握物质之间的转化,是学习元素化合物知识的基础.
掌握物质之间的转化,是学习元素化合物知识的基础.