题目内容
下表(图甲)为长式周期表的一部分,其中的编号分别代表对应的元素
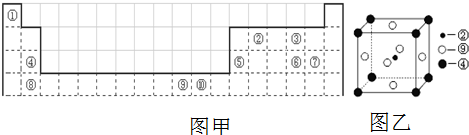
请回答下列问题
(1)表中属于d区的元素是 (填编号).
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图乙(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示).
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是 .
A.分子中含有氢键 B.属于非极性分子 C.含有4个σ键和1个π键D.该氢化物分子中,②原子采用SP2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成18电子分子X的电子式为 ;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为 .

请回答下列问题
(1)表中属于d区的元素是
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图乙(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
A.分子中含有氢键 B.属于非极性分子 C.含有4个σ键和1个π键D.该氢化物分子中,②原子采用SP2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为H、②为C、③为O、④为Mg、⑤为Al、⑥为S、⑦为Cl、⑧为Ca、⑨为Ni、⑩为Cu.
(1)d区元素为周期表中3到10列元素;
(2)根据均摊法计算晶胞中各原子数目,进而确定化学式;
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志,该氢化物为C2H4;
(4)某元素电子排布式为nsnnpn+1,则n=2,故为N元素,该元素与元素①形成18电子分子X为N2H4,分子中N原子之间形成1对共用电子对,N原子与H原子之间形成1对共用电子对;该元素还可与元素①形成10电子的气体分子Y为NH3,将过量的NH3气体通入盛有硫酸铜水溶液的试管里,先生成氢氧化铜沉淀,而由生成四氨合铜络离子.
(1)d区元素为周期表中3到10列元素;
(2)根据均摊法计算晶胞中各原子数目,进而确定化学式;
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志,该氢化物为C2H4;
(4)某元素电子排布式为nsnnpn+1,则n=2,故为N元素,该元素与元素①形成18电子分子X为N2H4,分子中N原子之间形成1对共用电子对,N原子与H原子之间形成1对共用电子对;该元素还可与元素①形成10电子的气体分子Y为NH3,将过量的NH3气体通入盛有硫酸铜水溶液的试管里,先生成氢氧化铜沉淀,而由生成四氨合铜络离子.
解答:
解:由元素在周期表中位置,可知①为H、②为C、③为O、④为Mg、⑤为Al、⑥为S、⑦为Cl、⑧为Ca、⑨为Ni、⑩为Cu.
(1)d区元素为周期表中3到10列元素,故上述元素中⑨为d区元素,故答案为:⑨;
(2)晶胞中N原子数目为1、Mg原子数目为8×
=1、Ni原子数目为6×
=3,故该晶体化学式为MgNi3N,故答案为:MgNi3N;
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志,该氢化物为C2H4,
A.分子中没有氢键,故A错误;
B.是平面对称结构,分子中正负电荷重心重合,属于非极性分子,故B正确;
C.分子中存在4个C-H键,1个C=C双键,故含有5个σ键和1个π键,故C错误;
D.该氢化物分子中,C原子成3个σ键,没有孤电子对,碳原子采用SP2杂化,故D正确,
故选:BD;
(4)某元素电子排布式为nsnnpn+1,则n=2,故为N元素,2s能级2个电子为1对孤电子对,该元素与元素①形成18电子分子X为N2H4,分子中N原子之间形成1对共用电子对,N原子与H原子之间形成1对共用电子对,其电子式为 ;该元素还可与元素①形成10电子的气体分子Y为NH3,将过量的NH3气体通入盛有硫酸铜水溶液的试管里,先生成氢氧化铜沉淀,而由生成四氨合铜络离子,看到的现象为:开始生成蓝色沉淀,后蓝色沉淀溶解,溶液变为深蓝色,
;该元素还可与元素①形成10电子的气体分子Y为NH3,将过量的NH3气体通入盛有硫酸铜水溶液的试管里,先生成氢氧化铜沉淀,而由生成四氨合铜络离子,看到的现象为:开始生成蓝色沉淀,后蓝色沉淀溶解,溶液变为深蓝色,
故答案为:1; ;开始生成蓝色沉淀,后蓝色沉淀溶解,溶液变为深蓝色.
;开始生成蓝色沉淀,后蓝色沉淀溶解,溶液变为深蓝色.
(1)d区元素为周期表中3到10列元素,故上述元素中⑨为d区元素,故答案为:⑨;
(2)晶胞中N原子数目为1、Mg原子数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志,该氢化物为C2H4,
A.分子中没有氢键,故A错误;
B.是平面对称结构,分子中正负电荷重心重合,属于非极性分子,故B正确;
C.分子中存在4个C-H键,1个C=C双键,故含有5个σ键和1个π键,故C错误;
D.该氢化物分子中,C原子成3个σ键,没有孤电子对,碳原子采用SP2杂化,故D正确,
故选:BD;
(4)某元素电子排布式为nsnnpn+1,则n=2,故为N元素,2s能级2个电子为1对孤电子对,该元素与元素①形成18电子分子X为N2H4,分子中N原子之间形成1对共用电子对,N原子与H原子之间形成1对共用电子对,其电子式为
 ;该元素还可与元素①形成10电子的气体分子Y为NH3,将过量的NH3气体通入盛有硫酸铜水溶液的试管里,先生成氢氧化铜沉淀,而由生成四氨合铜络离子,看到的现象为:开始生成蓝色沉淀,后蓝色沉淀溶解,溶液变为深蓝色,
;该元素还可与元素①形成10电子的气体分子Y为NH3,将过量的NH3气体通入盛有硫酸铜水溶液的试管里,先生成氢氧化铜沉淀,而由生成四氨合铜络离子,看到的现象为:开始生成蓝色沉淀,后蓝色沉淀溶解,溶液变为深蓝色,故答案为:1;
 ;开始生成蓝色沉淀,后蓝色沉淀溶解,溶液变为深蓝色.
;开始生成蓝色沉淀,后蓝色沉淀溶解,溶液变为深蓝色.
点评:本题是对物质结构的考查,涉及元素周期表、晶胞计算、分子结构、杂化轨道、配合物等,难度中等,需要学生具备扎实的基础.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的( )| A、此有机物含有如下的官能团:含有碳碳双键、羟基、羰基、羧基 |
| B、1mol该有机物与NaOH 溶液反应,耗2mol.与氢气反应耗氢气5mol |
| C、该有机分子中没有一个有手性碳 |
| D、该有机物不存在顺反异构 |
如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )
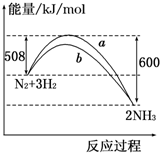

| A、该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ/mol |
| B、a曲线是加入催化剂时的能量变化曲线 |
| C、加入催化剂,该化学反应的反应热改变 |
| D、在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>Q |
青少年及成人缺乏某种微量元素将导致甲状腺肿大,而且会造成智力损坏,该微量元素是( )
| A、碘 | B、铁 | C、钙 | D、碳 |
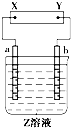 图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,电解一段时间后,再加入相应的物质,溶液能与原来溶液完全一样.符合这一情况的是下表中的( )
图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,电解一段时间后,再加入相应的物质,溶液能与原来溶液完全一样.符合这一情况的是下表中的( ) (1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.
(1)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.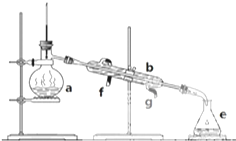 掌握仪器名称、组装及使用方法是中学化学实验的基础,图为实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,图为实验装置.