题目内容
19.下列除杂试剂的选择或除杂操作不正确的是( )| 选项 | 括号内为杂质 | 除杂试剂 | 除杂操作 |
| A | Fe(Al)粉 | NaOH溶液 | 在过量的NaOH溶液中充分反应后过滤 |
| B | Na2O2(Na2O)固体 | O2 | 在纯氧气中加热 |
| C | FeCl2(FeCl3)溶液 | Fe粉 | 加入过量Fe粉,充分反应后过滤 |
| D | Na2CO3(NaHCO3) 溶液 | CO2 | 通入过量的CO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.铝与氢氧化钠反应生成偏铝酸钠,铁不反应;
B.Na2O与氧气反应生成Na2O2;
C.铁能与氯化铁反应生成氯化亚铁;
D.二氧化碳与碳酸氢钠不反应.
解答 解:A.铝与氢氧化钠反应生成偏铝酸钠,铁不反应,过滤可除杂,故A正确;
B.Na2O与氧气反应生成Na2O2,可与氧气进一步反应而除去杂质,故B正确;
C.铁能与氯化铁反应生成氯化亚铁,可除杂,故C正确;
D.二氧化碳与碳酸氢钠不反应,与碳酸钠能反应,将原物质除去,故D错误.
故选D.
点评 本题考查物质的分离、提纯方法的选择和应用,为高频考点,把握物质的性质、发生的反应及混合物分离方法为解答的关键,注意反应中不能引入新的杂质,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
10.一定条件下合成乙烯6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$ CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法错误的是( )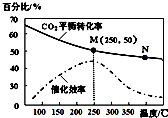

| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 平衡常数:KM>KN | |
| C. | 催化剂可能会影响CO2的平衡转化率 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
7.下列各项叙述中正确的是( )
| A. | 将适量氯化铁饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体 | |
| B. | 若需要使用0.100mol/L的CuSO4溶液480ml,可用12g胆矾及相应容器配制 | |
| C. | 用分液漏斗、烧杯、漏斗架、饱和碳酸钠溶液可除去乙酸乙酯中的乙酸 | |
| D. | 实验室从海带里提取碘的过程是:灼烧、溶解、过滤、萃取 |
14.工业上用反应 3Cl2+2NH3=N2+6HCl 检查氯气管道是否漏气,下列说法正确的是( )
| A. | 该反应属于复分解反应 | B. | 该反应中Cl2是还原剂 | ||
| C. | 该反应中NH3发生还原反应 | D. | 该反应生成1molN2有6mol电子转移 |
4.下列关于物质的分类或变化说法正确的是( )
| A. | 稀硫酸、NaCl溶液是实验室常见的强电解质 | |
| B. | 二氧化氮经加压凝成无色液体为物理变化 | |
| C. | Na2O•SiO2是一种简单的硅酸盐,可溶于水 | |
| D. | 溴水滴入植物油中振荡褪色,说明溴被植物油从溴水中萃取出来 |
11.图为一种天然产物,具有一定除草功效.下列有关该化合物的说法正确的是 ( )
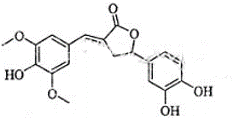

| A. | 分子中含有三种含氧官能团 | |
| B. | 1mol该化合物最多能与6molNaOH反应 | |
| C. | 既能与FeC13发生显色反应,也能和NaHCO3反应放出CO2 | |
| D. | 既可以发生取代反应,又能够发生加成反应. |
8.在密闭容器中充入CO2、CO、H2、C2H6的混合气体m g,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增重m g,则相同条件下,CO2与C2H6的体积比为( )
| A. | 4:1 | B. | 2:1 | ||
| C. | 1:1 | D. | 缺少条件,无法计算 |