题目内容
7.下列各项叙述中正确的是( )| A. | 将适量氯化铁饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体 | |
| B. | 若需要使用0.100mol/L的CuSO4溶液480ml,可用12g胆矾及相应容器配制 | |
| C. | 用分液漏斗、烧杯、漏斗架、饱和碳酸钠溶液可除去乙酸乙酯中的乙酸 | |
| D. | 实验室从海带里提取碘的过程是:灼烧、溶解、过滤、萃取 |
分析 A.搅拌能够使胶体聚沉;
B.依据m=CVM计算需要溶质的质量;
C.乙酸能够与碳酸钠溶液反应生成易溶于水的乙酸钠,乙酸乙酯不溶于饱和碳酸钠溶液;
D.碘以离子形式存在,需要加氧化剂氧化.
解答 解:A.将适量FeCl3饱和溶液滴入沸水中并不断搅拌,搅拌能够使胶体聚沉所以不能得到胶体,故A错误;
B.实验室没有480mL的容量瓶,应选择大于480mL且规格相近的容量瓶,故应选择500mL容量瓶;需要硫酸铜的质量为0.1mol•L-1×0.5L×160g/mol=8.0g,故B错误;
C.饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇,反应后分液,则给出的仪器可完成分液操作,故C正确;
D.碘以离子形式存在,需要加氧化剂氧化,则从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→氧化→萃取,故D错误;
故选C.
点评 本题考查化学实验方案的评价,明确实验原理是解题关键,注意对相关实验知识的积累,题目难度不大.

练习册系列答案
相关题目
17.标准状况下,质量相同的下列物质,体积最小的是( )
| A. | 氢气 | B. | 二氧化碳 | C. | 氧气 | D. | 氮气 |
15.通常人们把拆开1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看成该化学键的键能.已知热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol请根据热化学方程式和表中数据计算N≡N键的键能x约为( )
| 化学键 | H-H | N≡N | H-N |
| 键能 | 436 kJ/mol | x | 391kJ/mol |
| A. | 431kJ/mol | B. | 946kJ/mol | C. | 649kJ/mol | D. | 869kJ/mol |
2.下列关于Na2O与Na2O2的说法正确的是( )
| A. | 二者阴阳离子个数之比都为2:1 | |
| B. | 二者都能与CO2发生化合反应生成Na2CO3 | |
| C. | 二者都是强氧化剂 | |
| D. | 1molNa2O2与足量盐酸反应,转移电子的物质的量为2mol |
19.下列除杂试剂的选择或除杂操作不正确的是( )
| 选项 | 括号内为杂质 | 除杂试剂 | 除杂操作 |
| A | Fe(Al)粉 | NaOH溶液 | 在过量的NaOH溶液中充分反应后过滤 |
| B | Na2O2(Na2O)固体 | O2 | 在纯氧气中加热 |
| C | FeCl2(FeCl3)溶液 | Fe粉 | 加入过量Fe粉,充分反应后过滤 |
| D | Na2CO3(NaHCO3) 溶液 | CO2 | 通入过量的CO2 |
| A. | A | B. | B | C. | C | D. | D |
17.海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法不正确的是( )
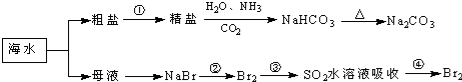

| A. | 工业上通过电解熔融状态MgCl2制取金属镁 | |
| B. | 在第②、④步骤中,溴元素均被氧化 | |
| C. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| D. | 制取NaHCO3的反应是利用其溶解度小于NaCl |
 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是: