题目内容
10.一定条件下合成乙烯6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$ CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法错误的是( )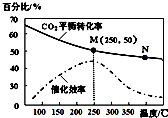
| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 平衡常数:KM>KN | |
| C. | 催化剂可能会影响CO2的平衡转化率 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
分析 A、温度升高化学反应速率加快,催化剂的催化效率降低;
B、升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动;
C、根据图象,当温度高于250℃,升高温度二氧化碳的平衡转化率减低,则平衡逆向移动;
D、设开始投料n(H2)为3mol,则n(CO2)为1mol,所以当在M点平衡时二氧化碳的转化率为50%,据此列三段式计算.
解答 解:A、化学反应速率随温度的升高而加快,催化剂的催化效率降低,所以v(M)有可能小于v(N),故A正确;
B、升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故B正确;
C、根据图象,当温度高于250℃,升高温度二氧化碳的平衡转化率减低,则平衡逆向移动,但催化剂只影响反应速率,不影响平衡移动和转化率,故C错误;
D、设开始投料n(H2)为3mol,则n(CO2)为1mol,所以当在M点平衡时二氧化碳的转化率为50%
所以有6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g)
开始 3 1 0 0
转化 1.5 0.5 0.25 1
平衡 1.5 0.5 0.25 1
所以乙烯的体积分数为$\frac{0.25}{1.5+0.5+0.25+1}$×100%=7.7%,故D正确;
故选C.
点评 本题考查了图象分析化学反应速率的影响因素、平衡计算、平衡移动等,题目难度不大.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
20.下列互为同素异形体的是( )
| A. | 168O和188O | B. | CH3CH3和C6H6 | C. | 金刚石和石墨 | D. | NO和 NO2 |
1.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | 乙酸 | B. | 氨气 | C. | NH4HCO3 | D. | 氯气 |
15.通常人们把拆开1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看成该化学键的键能.已知热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol请根据热化学方程式和表中数据计算N≡N键的键能x约为( )
| 化学键 | H-H | N≡N | H-N |
| 键能 | 436 kJ/mol | x | 391kJ/mol |
| A. | 431kJ/mol | B. | 946kJ/mol | C. | 649kJ/mol | D. | 869kJ/mol |
2.下列关于Na2O与Na2O2的说法正确的是( )
| A. | 二者阴阳离子个数之比都为2:1 | |
| B. | 二者都能与CO2发生化合反应生成Na2CO3 | |
| C. | 二者都是强氧化剂 | |
| D. | 1molNa2O2与足量盐酸反应,转移电子的物质的量为2mol |
19.下列除杂试剂的选择或除杂操作不正确的是( )
| 选项 | 括号内为杂质 | 除杂试剂 | 除杂操作 |
| A | Fe(Al)粉 | NaOH溶液 | 在过量的NaOH溶液中充分反应后过滤 |
| B | Na2O2(Na2O)固体 | O2 | 在纯氧气中加热 |
| C | FeCl2(FeCl3)溶液 | Fe粉 | 加入过量Fe粉,充分反应后过滤 |
| D | Na2CO3(NaHCO3) 溶液 | CO2 | 通入过量的CO2 |
| A. | A | B. | B | C. | C | D. | D |
20.下列离子方程式中,错误的是( )
| A. | 铜丝与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 少量碳酸氢钠与氢氧化钙反应:HCO3-+OH-+Ca2+═CaCO3↓+H2O | |
| C. | 稀盐酸与氢氧化钠溶液混合:H++OH-═H2O | |
| D. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
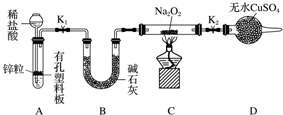 Na2O2可用作漂白剂和呼吸面具中的供氧剂.
Na2O2可用作漂白剂和呼吸面具中的供氧剂.