题目内容
8.在密闭容器中充入CO2、CO、H2、C2H6的混合气体m g,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增重m g,则相同条件下,CO2与C2H6的体积比为( )| A. | 4:1 | B. | 2:1 | ||
| C. | 1:1 | D. | 缺少条件,无法计算 |
分析 根据2CO2+2Na2O2═2Na2CO3+O2可知,固体增重为与CO2等物质的量的CO的质量,根据2Na2O2+2H2O=4NaOH+O2可知,固体增重为与H2O等物质的量的H2的质量;
在密闭容器中充入CO2、CO、H2、C2H6的混合气体共mg,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加mg,则反应后CO2、CO、H2、C2H6混合气体中所有元素均被吸收,故原混合物中CO2与C2H6相当于CO、H2混合,只要CO2与C2H6混合物中C、O原子数之比满足1:1即可.
解答 解:根据2CO2+2Na2O2═2Na2CO3+O2可知:固体增重为与CO2等物质的量的CO的质量,
根据2Na2O2+2H2O=4NaOH+O2可知:固体增重为与H2O等物质的量的H2的质量,
在密闭容器中充入CO2、CO、H2、C2H6的混合气体共mg,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加mg,则反应后CO2、CO、H2、C2H6混合气体中所有元素均被吸收,
故原混合物中CO2与C2H6相当于CO、H2混合,则CO2与C2H6混合物中C、O原子数之比满足1:1,
所以CO2与C2H6的体积之比为2:1,
故选B.
点评 本题考查混合物反应计算,题目难度中等,注意利用方程式判断固体质量增重情况,试题侧重考查学生分析能力,注意掌握常见反应原理,能够掌握书写反应方程式并得出质量变化特点为解答关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.下列除杂试剂的选择或除杂操作不正确的是( )
| 选项 | 括号内为杂质 | 除杂试剂 | 除杂操作 |
| A | Fe(Al)粉 | NaOH溶液 | 在过量的NaOH溶液中充分反应后过滤 |
| B | Na2O2(Na2O)固体 | O2 | 在纯氧气中加热 |
| C | FeCl2(FeCl3)溶液 | Fe粉 | 加入过量Fe粉,充分反应后过滤 |
| D | Na2CO3(NaHCO3) 溶液 | CO2 | 通入过量的CO2 |
| A. | A | B. | B | C. | C | D. | D |
3.下列关于各图象的解释或结论正确的是( )
| A. |  热化学方程式是H2(g)+$\frac{1}{2}$O2(g)=H2O(g) DH=-241.8 kJ/mol | |
| B. | 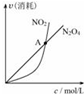 对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 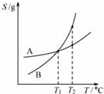 将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | |
| D. |  HA的酸性强于HB |
20.下列离子方程式中,错误的是( )
| A. | 铜丝与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 少量碳酸氢钠与氢氧化钙反应:HCO3-+OH-+Ca2+═CaCO3↓+H2O | |
| C. | 稀盐酸与氢氧化钠溶液混合:H++OH-═H2O | |
| D. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
17.海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法不正确的是( )
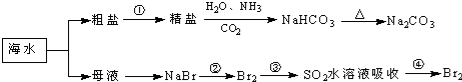

| A. | 工业上通过电解熔融状态MgCl2制取金属镁 | |
| B. | 在第②、④步骤中,溴元素均被氧化 | |
| C. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| D. | 制取NaHCO3的反应是利用其溶解度小于NaCl |
18.将0.2mol/L HF溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显酸性,下列关系不正确的是( )
| A. | c(HF)<c(F-) | B. | c(Na+)<c(F-) | ||
| C. | c(F-)-c(HF)=c(H+)-c(OH-) | D. | c(HF)+c(F-)=0.1mol/L |
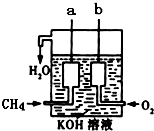 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是: