题目内容
12.相同质量的SO2 和SO3它们之间的关系是( )| A. | 所含硫原子的物质的量之比为1:1 | B. | 硫元素的质量之比为5:4 | ||
| C. | 氧元素的质量之比为5:6 | D. | 所含氧原子的物质的量之比为3:2 |
分析 已知M(SO2)=64g/mol,M(SO3)=80g/mol,结合n=$\frac{m}{M}$计算.
解答 解:设两种物质的质量都为1g,则SO2和SO3的物质的量之比为$\frac{1g}{64g/mol}:\frac{1g}{80g/mol}$=5:4,
A.所含硫原子的物质的量之比等于SO2和SO3的物质的量之比,比值为5:4,故A错误;
B.硫元素的质量之比等于硫原子的物质的量之比等于SO2和SO3的物质的量之比,为$\frac{1g}{64g/mol}:\frac{1g}{80g/mol}$=5:4,故B正确;
C.氧元素的质量之比等于氧原子的物质的量之比,为$\frac{1g}{64g/mol}×2:\frac{1g}{80g/mol}×\;3$=10:12=5:6,故C正确;
D.氧原子的物质的量比为$\frac{1g}{64g/mol}×2:\frac{1g}{80g/mol}×\;3$=10:12,故D错误.
故选BC.
点评 本题考查物质的量的相关计算,为高频考点,侧重学生的分析、计算能力的考查,注意把握物质的构成特点,难度不大.

练习册系列答案
相关题目
7.可用来鉴别己烯、甲苯、己烷、苯酚溶液的一组试剂是( )
| A. | 溴水、FeCl3溶液 | B. | 溴水、酸性KMnO4溶液 | ||
| C. | 溴水、Na2CO3溶液 | D. | FeCl3溶液、酸性KMnO4溶液 |
4.下列说法中不正确的是( )
| A. | 食盐可作调味剂,也可作食品防腐剂 | |
| B. | 纯碱可用于清洗油污 | |
| C. | 侯式制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2═Na2O2 |
1.下列有关化学平衡移动叙述中正确的是( )
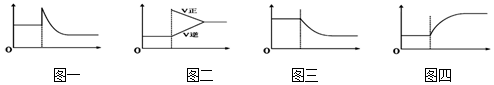

| A. | 可逆反应:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硫酸,溶液变橙色,氢离子浓度随时间变化曲线如图一 | |
| B. | 可逆反应Co(H2O)62+(粉红色)+4Cl-?CoCl42- (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如图二 | |
| C. | 可逆反应:2NO2?N2O4达平衡状态呈红棕色,加压红棕色变深,NO2物质的量随时间变化曲线如图三 | |
| D. | 可逆反应:N2(g)+3H2(g)?2NH3(g)△H<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如图四 |
2.下列各组物质中互为同位素的是( )
| A. | ${\;}_{20}^{40}$Ca和${\;}_{18}^{40}$Ar | B. | 16O和18O | ||
| C. | H2O和H2O2 | D. | O3和O2 |