题目内容
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)═2C(g).若经2s后测得C的浓度为0.6mol?L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.6mol?L-1?s-1
②用物质B表示的反应的平均速率为0.15mol?L-1?s-1
③2s时物质A的转化率为30%
④2s时物质B的浓度为0.3mol?L-1
其中正确的是( )
①用物质A表示的反应平均速率为0.6mol?L-1?s-1
②用物质B表示的反应的平均速率为0.15mol?L-1?s-1
③2s时物质A的转化率为30%
④2s时物质B的浓度为0.3mol?L-1
其中正确的是( )
| A、①③ | B、①④ | C、②③ | D、③④ |
考点:化学平衡的计算
专题:化学平衡专题
分析:反应2s后测得C的浓度为0.6mol/L,物质的量=0.6mol/L×2L=1.2mol;
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s末量(mol) 2.8 1.4 1.2
根据概念计算选项中的速率、转化率和浓度.
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s末量(mol) 2.8 1.4 1.2
根据概念计算选项中的速率、转化率和浓度.
解答:
解:反应2s后测得C的浓度为0.6mol/L,物质的量=0.6mol/L×2L=1.2mol;
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s末量(mol) 2.8 1.4 1.2
①用物质A表示2 s内的平均反应速率=
=0.3 mol/(L?s),故①错误;
②用物质B表示2 s内的平均反应速率=
=0.15 mol/(L?s)故②正确;
③2 s后物质A的转化率=
×100%=30%,故③正确;
④2 s后物质B的浓度=
=0.7mol/L,故④错误;
故②③正确;
故选C.
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s末量(mol) 2.8 1.4 1.2
①用物质A表示2 s内的平均反应速率=
| ||
| 2s |
②用物质B表示2 s内的平均反应速率=
| ||
| 2s |
③2 s后物质A的转化率=
| 1.2mol |
| 4mol |
④2 s后物质B的浓度=
| 1.4mol |
| 2L |
故②③正确;
故选C.
点评:本题考查化学反应的基本计算,理解反应速率、转化率、浓度概念和计算应用是关键,题目较简单.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A、碱、纯碱、Na2CO3 |
| B、单质、氯水、Cl2 |
| C、酸、硫酸、H2S |
| D、酸性氧化物、干冰、CO2 |
 常温下,向100mL 0.01mol?L-1盐酸中逐滴加入0.02mol?L-1 MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中不正确的是( )
常温下,向100mL 0.01mol?L-1盐酸中逐滴加入0.02mol?L-1 MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中不正确的是( )| A、MOH是弱碱 | ||
| B、N点c(Cl-)=c(M+) | ||
C、随着MOH溶液的滴加,比值
| ||
| D、K点对应的溶液c(MOH)+c(OH-)-c(H+)=0.001mol?L-1 |
下列说法中,不正确的是( )
| A、氢氧化铁胶体中分散质微粒直径为1-100nm |
| B、可利用渗析的原理提纯胶体 |
| C、可用丁达尔现象判断胶体的制备是否成功 |
| D、电泳现象说明了胶体带电荷 |
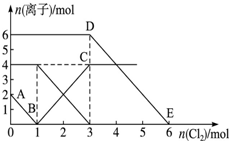 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:Cl2+2Br-═2Cl-+Br2,2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.则下列说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:Cl2+2Br-═2Cl-+Br2,2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.则下列说法中不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、原混合溶液中FeBr2的物质的量为3mol |
| C、线段AB表示Fe2+被氯气氧化 |
| D、原溶液中:n(Fe2+):n(I-):n(Br-)═2:1:3 |
下列变化过程中,共价键被破坏的是 ( )
| A、烧碱固体溶于水 |
| B、氯化氢气体溶于水 |
| C、二氧化碳变成干冰 |
| D、碘溶于酒精 |
用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
| A、SO2、CS2、HI都是直线形的分子 |
| B、BF3键角为120°,SnBr2键角大于120° |
| C、COCl2、BF3、SO3都是平面三角形的分子 |
| D、PCl3、NH3、PCl5都是三角锥形的分子 |
在标准状况下,若8g气体A和22g CO2所含分子数相等,则气体A的密度为( )
| A、0.714g/mL |
| B、0.714g/L |
| C、0.179g/L |
| D、0.275g/L |
 某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4mol?L-1的盐酸,再根据生成的CO2体积计算出Na2CO3质量,从而进一步计算出样品中变质NaOH的质量.实验测得加入盐酸的体积与产生CO2的体积(标况)关系如图所示:
某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4mol?L-1的盐酸,再根据生成的CO2体积计算出Na2CO3质量,从而进一步计算出样品中变质NaOH的质量.实验测得加入盐酸的体积与产生CO2的体积(标况)关系如图所示: