��Ŀ����
11���ϳɰ���ҵ����ȡԭ��H2�漰����������Ӧ����ij�����¡����ݵ��ܱ�������ͬʱ���������������淴Ӧ�����ף�C��s��+H2O��g��?CO��g��+H2��g�������ң�CO��g��+H2O��g��?H2��g��+CO2��g����
��1�����������������ٷ����仯ʱ���ܱ�ʾ���ף����ң����ﵽ��ѧƽ��״̬����B
�ٻ��������ܶ�
�ڻ�������ѹǿ
�ۻ�������ƽ����Է���������̿������
��v��CO��=v��CO2��
A���٢ڢ�B���٢ڢۢ�C���٢ڢۢܢ�D���٢ۢܢ�
��2����2L�����ܱ�������ͨ��1mol N2��g����3mol H2��g����������Ӧ��3H2��g��+N2��g��?2NH3��g�������ȷ�Ӧ��
���ѹǿ-ʱ��ͼ����ͼ�ף����p2=0.8p1����ʱ�¶�����ʼ�¶���ͬ���ڴﵽƽ��ǰijһʱ�̣�t1�������ı�һ���������õ���ͼ��ͼ��
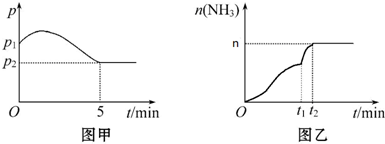
����ͼ�ף���Ӧ��ʼ��ƽ��ʱNH3��ƽ����Ӧ����Ϊ0.08mol/��L•min��ƽ��ʱ������ת����Ϊ40%��
����ͼ�ң�����˵����ȷ����AC������ĸ��
A��t1ʱ�̿����Ǽ����˴���B���ı���������ʹH2100%ת��ΪNH3
C������N2��Ũ�ȣ��������H2��ת���� D��t2ʱ�̣�N2��Ũ����NH3��Ũ��֮��Ϊ1��2��
���� ��1����ѧ��Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬�ɴ�������һЩ���������䣬ע��÷�Ӧ��AΪ�����Լ���Ӧ������Ļ�ѧ�������Ĺ�ϵ��
��2�������ݻ�ѧƽ�������ʽ��ʽ����õ�ƽ�����ʵ���������$v=\frac{��c}{��t}$���㣻
��A��t1ʱ�̷�Ӧ���ʼӿ죻
B�����淴Ӧ��Ӧ��ת���ʲ�����Ϊ100%��
C������һ�ַ�Ӧ���Ũ�ȣ�����������һ�ַ�Ӧ���ת���ʣ�
D��t2ʱ�̣���Ӧ���еij̶�δ֪��
��� �⣺��1����Ӧ���ף�C��s��+H2O��g��?CO��g��+H2��g�������ң�CO��g��+H2O��g��?H2��g��+CO2��g�������������������ٷ����仯ʱ��
���ں�����ϵ�л��������ܶȣ�˵��������������䣬���淴Ӧ������ȣ�����ȷ��
�����ߵ��������������ȣ���������ѹǿ���ֲ��䣬˵����ƽ��״̬������ȷ��
�۷�Ӧǰ���������ƽ����Է��������ı�ķ�Ӧ������������ƽ����Է�����������ʱ���÷�Ӧ�ﵽƽ��״̬���������ж��Ƿ�ﵽƽ��״̬������ȷ��
�ܸ���ֵ������ٸı䣬˵����ƽ��״̬������ȷ��
��CO��CO2ϵ����ͬ��v��CO��=v��CO2��ʼ�ճ���������˵����ƽ��״̬���ʴ���
�ʴ�Ϊ��B��
��2����p2=0.8p1��ƽ��ʱ�������ʵ���Ϊ��ʼ���ʵ�����0.8����������������ʵ���Ϊ��1+3����0.8=3.2mol��
3H2��g��+N2��g��?2NH3��g�������ȷ�Ӧ��
��ʼ��mol��3 1 0
�仯��mol��3x x 2x
ƽ�⣨mol��3-3x 1-x 2x
��3-3x��+��1-x��+2x=3.2�����x=0.4��
��Ӧ��ʼ��ƽ��ʱNH3��ƽ����Ӧ����v=$\frac{��c}{��t}$=$\frac{\frac{2��0.4}{2}}{5}$=0.08mol/��L•min����
ƽ��ʱ������ת����Ϊ$\frac{3��0.4}{3}��100%$=40%��
�ʴ�Ϊ��0.08mol/��L•min����40%��
��A��t1ʱ�̷�Ӧ���ʼӿ죬�����Ǽ����˴���������ȷ��
B�����淴Ӧ��Ӧ��ת���ʲ�����Ϊ100%���ʴ���
C������һ�ַ�Ӧ���Ũ�ȣ�����������һ�ַ�Ӧ���ת���ʣ�������N2��Ũ�ȣ��������H2��ת���ʣ�����ȷ��
D��t2ʱ�̣���Ӧ���еij̶�δ֪���ʴ���
�ʴ�Ϊ��AC��
���� ���⿼���˻�ѧƽ��ļ���Ӧ�ã���Ҫ��ƽ��Ũ�ȡ���Ӧ���ʸ���ļ���Ӧ�ã����ջ����ǹؼ�����Ŀ�ϼ�

| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
| A�� | 7 | B�� | 8 | C�� | 9 | D�� | 10 |
| Ԫ�ش��� | X | Y | Z | M | R | Q | |
| ԭ�Ӱ뾶����10-10 m�� | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| ��Ҫ���ϼ� | ������� | +1 | +7 | +3 | +2 | +5 | -- |
| ����� | -- | -1 | -- | -- | -3 | -2 | |
| A�� | ���Ӱ뾶r��R3-����r��X+����r��Z3+�� | |
| B�� | Ԫ��X��Q�γɵĻ������в����ܺ��й��ۼ� | |
| C�� | Q2-��R3-������ʧȥ���� | |
| D�� | Y�ĺ����������һ����R�ĺ����������ǿ |

| A�� | �÷�Ӧ�����ȷ�Ӧ | |
| B�� | 2 mol AB������������1 mol A2��1 mol B2�������� | |
| C�� | ����1 mol A-A����1 mol B-B���ܷų�x kJ���� | |
| D�� | ����2 mol A-B����Ҫ����y kJ������ |
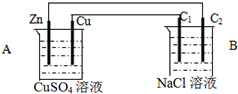 ����ͼװ�ý���ʵ�飬C1��C2��Ϊʯī�����ش���������
����ͼװ�ý���ʵ�飬C1��C2��Ϊʯī�����ش��������� 
 ����д����b����c�Ļ�ѧ����ʽ4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O
����д����b����c�Ļ�ѧ����ʽ4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O
 ��
��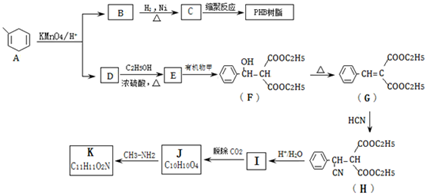
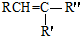 $\stackrel{KMnO_{4}/H+}{��}$RCOOH+
$\stackrel{KMnO_{4}/H+}{��}$RCOOH+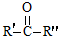
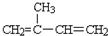 ��B�Ľṹ��ʽ��
��B�Ľṹ��ʽ��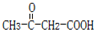 ��
��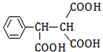 ��
��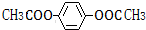 ��
��
 ��
��