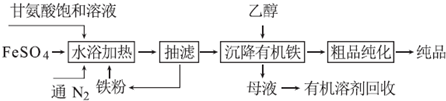
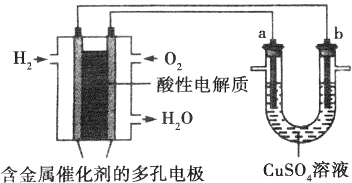
题目内容
1.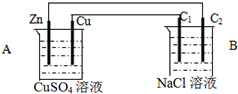 按如图装置进行实验,C1与C2均为石墨棒,回答下列问题
按如图装置进行实验,C1与C2均为石墨棒,回答下列问题 (1)判断装置的名称:A池为原电池B池为电解池
(2)铜极为正极,电极反应式为Cu2++2e-=Cu
(3)石墨棒C1为阳极,电极反应式为2Cl--2e-=Cl2↑.
分析 该装置中A能自发的进行氧化还原反应为原电池,B为电解池;锌、铜原电池中,锌易失电子作负极,铜作正极,B中连接铜的电极为阳极,连接锌的电极为负极,电解池中阳极上氯离子放电,阴极上氢离子放电,据此回答判断.
解答 解:(1)A中金属锌和硫酸铜之间能自发的进行氧化还原反应,能将化学能转化为电能,所以为原电池,B有外接电源,属于电解池,故答案为:原电池;电解池;
(2)锌、铜原电池中,锌易失电子作负极,铜作正极,铜电极上铜离子得电子生成铜单质,2e-+Cu2+=Cu,故答案为:正;Cu2++2e-=Cu;
(3)B中连接铜的电极为阳极,连接锌的电极为负极,电解池中阳极上氯离子放电,氯离子失电子析出氯气的过程,2Cl--2e-=Cl2↑,
故答案为:阳;2Cl--2e-=Cl2↑.
点评 本题考查了原电池和电解池原理,根据是否能自发进行反应结合原电池构成条件来确定原电池,正确判断原电池和电解池是解本题关键,难点是电极反应式的书写,难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
9.用下列实验装置进行的实验,能达到目的是( )
| A. |  验证Na与水反应的热效应 | B. |  制氢氧化亚铁 | ||
| C. |  碳酸氢钠受热分解 | D. |  制备少量氧气 |
6.以下说法中正确的是( )
| A. | △H<0的反应均是自发反应 | |
| B. | 自发进行的反应一定能迅速进行 | |
| C. | 高锰酸钾加热分解是一个熵减小的过程 | |
| D. | 冰在室温下自动熔化成水,是熵增的重要结果 |
10.食品保鲜膜的材质有聚乙烯(PE)、聚氯乙烯(PVC)等种类.下列叙述错误的是( )
| A. | 等质量的聚乙烯(PE)和乙烯完全燃烧消耗氧气的量相等 | |
| B. | 废弃的PE和PVC均可回收利用以减少白色污染 | |
| C. | 将PVC薄膜放入试管中加强热,产生的气体可使湿润的蓝色石蕊试纸变红 | |
| D. | PVC的单体可由PE的单体与氯化氢加成制得 |