题目内容
20.下列叙述正确的是( )| A. | NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心 | |
| B. | CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心 | |
| C. | H2O是极性分子,分子中O原子和2个H原子不在一条直线上 | |
| D. | CO2是非极性分子,分子中C原子和2个O原子不在一条直线上 |
分析 根据价层电子对互斥理论确定微粒空间构型和中心原子杂化方式的判断,正负电荷重心重合的分子是非极性分子,正负电荷重心不重合的是极性分子.
解答 解:A.N与3个H原子形成δ键,孤对电子数为$\frac{5-3}{2}$=1,所以N原子采用sp3杂化,为三角锥形分子,该分子正负电荷重心不重合,为极性分子,分子空间构型错误,故A错误;
B.CCl4中C与4个Cl形成4个δ键,孤对电子数为0,所以C原子采用sp3杂化,为正四面体结构,该分子正负电荷重心重合,为非极性分子,分子空间构型错误,故B错误;
C.H2O中O与2个H形成δ键,孤对电子数为$\frac{6-2}{2}$=2,所以O原子采用sp3杂化,为V形分子,分子中O原子和2个H原子不在一条直线上,该分子正负电荷重心不重合,为极性分子,分子空间构型也正确,故C正确;
D.CO2中C与2个O形成δ键,孤对电子数为$\frac{4-2×2}{2}$=0,所以C原子采用sp杂化,为直线形分子,分子中C原子和2个O原子在一条直线上,该分子正负电荷重心重合,为非极性分子,故D错误;
故选C.
点评 本题考查了分子的空间构型、分子极性的判断,根据价层电子对互斥理论及正负电荷重心是否重合来分析解答即可,注意把握δ键数以及孤对电子数目判断,题目难度中等.

练习册系列答案
相关题目
8.下列互为同素异形体的是( )
| A. | H2O与H2O2 | B. | ${\;}_{6}^{12}C$与${\;}_{6}^{14}C$ | ||
| C. | 石墨与金刚石 | D. | 正丁烷与异丁烷 | ||
| E. | . |
15.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如图1:
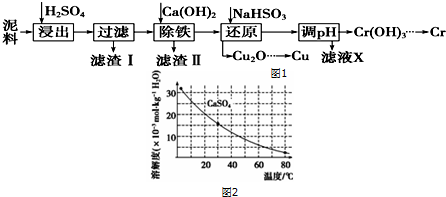
已知部分物质沉淀的pH如下表,CaSO4的溶解度曲线如图2:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有CuSO4.
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围是3.2~4.3,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80℃,趁热过滤
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是产生SO2污染环境.
(4)当离子浓度小于或等于1×10-5mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥4.0×10-9 mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].

已知部分物质沉淀的pH如下表,CaSO4的溶解度曲线如图2:
| 物质 | Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围是3.2~4.3,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80℃,趁热过滤
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是产生SO2污染环境.
(4)当离子浓度小于或等于1×10-5mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥4.0×10-9 mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].
5.A、B两种烃的混合物,当混合物的质量一定时,无论A、B以何种比例混合,完全燃烧产生的CO2的量均相等.在①同分异构体,②同系物,③具有相同的最简式,④含碳的质量分数相同,符合上述条件的组合是( )
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
12.一定体积的甲烷在一定量O2中燃烧得到产物为CO,CO2和水蒸气,测得混合气体的质量为49.6g,将混合气体缓慢通过无水CaCl2时,CaCl2质量增加25.2g,则混合气体中CO2的质量为( )
| A. | 12.5g | B. | 13.2g | C. | 19.7g | D. | 24.4g |
9.在含有Na+、Cl-、CO32-离子的溶液中,能大量共存的离子是( )
| A. | K+ | B. | H+ | C. | Ca2+ | D. | Ag+ |
10.下列关于有机物说法正确的是( )
| A. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| B. | 75%(体积分数)的乙醇溶液常用于医疗消毒 | |
| C. | 苯和乙烯都可使溴的四氯化碳溶液褪色 | |
| D. | 含有醛基和羧基的有机物都能跟银氨溶液发生银镜反应 |

 +3Br2→
+3Br2→ ↓+3HBr
↓+3HBr