题目内容
20.下列各组顺序排列不正确的是( )| A. | 最高正价:P<S<Cl | B. | 原子半径:O<S<Cl | ||
| C. | 酸性强弱:H2SiO3<H2CO3<HNO3 | D. | 失电子能力:Na>Mg>Al |
分析 A.同一周期中,原子序数越大,最高正价越大(O、F除外);
B.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小;
C.非金属性越强,最高价氧化物对应水合物的酸性越强;
D.同一周期中,原子序数越大,金属性越弱,失电子能力越弱.
解答 解:A.P、S、Cl最外层电子数逐渐增多,最高正价分别为+5、+6、+7,则最高正价:P<S<Cl,故A正确;
B.O原子电子层最少,其原子半径最小;Cl、S具有相同电子层,核电荷数Cl>S,则原子半径大小为:O<Cl<S,故B错误;
C.非金属性Si<C<N,则最高价氧化物对应水合物的酸性强弱:H2SiO3<H2CO3<HNO3,故C正确;
D.Na、Mg、Al位于同一周期,原子序数:Na<Mg<Al,则金属性Na>Mg>Al,失电子能力:Na>Mg>Al,故D正确;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确元素周期律内容为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,试题培养了学生的灵活应用能力.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
10.下列各组物质中互为同位素的是( )
| A. | 136C和146C | B. | CH3CH2CH2CH3和CH3CH(CH3)CH3 | ||
| C. | 红磷和白磷 | D. | 甲烷和乙烷 |
11.下列现象与氢键有关的是( )
①HF的熔、沸点比HCl的熔、沸点高②NH3极易溶于水③冰的密度比液态水的密度小④水分子高温下很稳定.
①HF的熔、沸点比HCl的熔、沸点高②NH3极易溶于水③冰的密度比液态水的密度小④水分子高温下很稳定.
| A. | ①②③④ | B. | ①②③ | C. | ①② | D. | ①③ |
15.盐酸与块状CaCO3反应时,不能使反应的最初速率明显加快的是( )
| A. | 将盐酸的用量增加一倍 | B. | 盐酸的浓度增加一倍,用量减半 | ||
| C. | 温度升高30℃ | D. | 改用更小块的CaCO3 |
5.只用一种试剂就能鉴别Na2S、Na2SO3、Na2CO3、Na2SO4的是( )
| A. | BaCl2溶液 | B. | 品红溶液 | C. | 盐酸 | D. | NH4Cl |
12.下列变化属于物理变化的是( )
| A. | O2在放电条件下变成O3 | B. | 加热胆矾成无水硫酸铜 | ||
| C. | 漂白的草帽久置于空气中变黄 | D. | 石油分馏 |
9.运用化学反应原理研究卤族元素的性质具有重要意义.
(1)下列关于氯水的叙述正确的是aef(填写符号).
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,c(H+)/c(ClO-)减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中加入少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)常温下,已知25℃时有关弱酸的电离平衡离数:
写出84消毒液露置在空气中发生反应的离子方程式ClO-+CO2+H2O═HClO+HCO3-2HClO $\frac{\underline{\;光照\;}}{\;}$2H++2Cl-+O2↑.
(3)电解饱和食盐水可得到溶质为M的碱溶液,常温下将浓度为c1的M溶液与0.1mol•L-1的一元酸HA等体积混合,所得溶液pH=7,则c1≤ 0.1mol•L-1(填“≥”、“≤”或“=”),溶液中离子浓度的大小关系为c(Na+)=c(A-)>c(OH-)=c(H+).若将上述“0.1mol•L-1的一元酸HA”改为“pH=1的一元酸HA”,所得溶液的pH仍为7,则c1≥0.1mol•L-1.
(4)牙釉质对牙齿起着保护作用,其主要成分为羟基磷灰石(Ca5(PO4)3OH),研究证实氟磷灰石(Ca5(PO4)3F)比它更能抵抗酸的侵蚀,故含氟牙膏已使全世界千百万人较少龋齿,请写出羟基磷灰石的溶度积常数表达式Ksp=c5(Ca2+)c3(PO43-)c(OH-),氟离子与之反应转化的离子方程式为Ca5(PO4)3OH+F-═Ca5(PO4)3F+OH-.
(1)下列关于氯水的叙述正确的是aef(填写符号).
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,c(H+)/c(ClO-)减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中加入少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)常温下,已知25℃时有关弱酸的电离平衡离数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
(3)电解饱和食盐水可得到溶质为M的碱溶液,常温下将浓度为c1的M溶液与0.1mol•L-1的一元酸HA等体积混合,所得溶液pH=7,则c1≤ 0.1mol•L-1(填“≥”、“≤”或“=”),溶液中离子浓度的大小关系为c(Na+)=c(A-)>c(OH-)=c(H+).若将上述“0.1mol•L-1的一元酸HA”改为“pH=1的一元酸HA”,所得溶液的pH仍为7,则c1≥0.1mol•L-1.
(4)牙釉质对牙齿起着保护作用,其主要成分为羟基磷灰石(Ca5(PO4)3OH),研究证实氟磷灰石(Ca5(PO4)3F)比它更能抵抗酸的侵蚀,故含氟牙膏已使全世界千百万人较少龋齿,请写出羟基磷灰石的溶度积常数表达式Ksp=c5(Ca2+)c3(PO43-)c(OH-),氟离子与之反应转化的离子方程式为Ca5(PO4)3OH+F-═Ca5(PO4)3F+OH-.
10.用滴管吸取和滴加少量试剂时,下列操作中不正确的是( )
| A. | 将滴管伸入试剂瓶中,然后用手指头捏紧橡胶乳头,赶走滴管中的空气 | |
| B. | 向烧杯内滴加试剂时,将滴管悬空放在烧杯上方,将试剂滴下 | |
| C. | 取液后的滴管保持橡胶乳头在上,不可倒置或平放 | |
| D. | 除滴瓶上的滴管外,用过的滴管应立即用清水冲洗干净 |
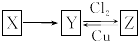 X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):
X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):