题目内容
16.在盛有少量氯水的试管中加入过量的溴化钾溶液,再加入少量四氯化碳,振荡静置后可观察到的现象是( )| A. | 溶液呈橙色不分层 | B. | 溶液分两层,上层呈橙色 | ||
| C. | 溶液分两层,下层呈橙色 | D. | 溶液呈紫色不分层 |
分析 氯气与KBr反应生成KCl和溴,溴易溶于四氯化碳,且四氯化碳的密度比水的密度大,以此来解答.
解答 解:氯气与KBr反应生成KCl和溴,溴易溶于四氯化碳,且四氯化碳的密度比水的密度大,四氯化碳与水分层,则振荡静置后可观察到的现象是溶液分两层、下层呈橙色,
故选C.
点评 本题考查混合物的分离提纯,为高频考点,把握发生的反应、萃取现象为解答的关键,侧重分析与应用能力的考查,注意卤素单质的性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.根据下表信息,判断以下叙述正确的是( )
表中为部分短周期元素的原子半径及主要化合价
表中为部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性H2T<H2R | B. | M与T形成的化合物具有两性 | ||
| C. | 单质与稀盐酸反应的快慢为L>Q | D. | L2+与R2-的核外电子数相等 |
7.实验室制取下列气体时,只能用排水法收集的是( )
| A. | CH4 | B. | SO2 | C. | NO | D. | NO2 |
4.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA | |
| B. | 1mol Na2CO3晶体中含CO32-离子数小于NA | |
| C. | 惰性电极电解食盐水,若线路中通过NA个电子,则阳极产生气体标况下11.2L | |
| D. | 0.1mol的CaO2中含阴离子数是0.2 NA |
11.下列现象与氢键有关的是( )
①HF的熔、沸点比HCl的熔、沸点高②NH3极易溶于水③冰的密度比液态水的密度小④水分子高温下很稳定.
①HF的熔、沸点比HCl的熔、沸点高②NH3极易溶于水③冰的密度比液态水的密度小④水分子高温下很稳定.
| A. | ①②③④ | B. | ①②③ | C. | ①② | D. | ①③ |
1.下列各组物质中互为同位素的是( )
| A. | 氧气、臭氧 | B. | 金刚石、石墨 | C. | 重氢、超重氢 | D. | 红磷、白磷 |
5.只用一种试剂就能鉴别Na2S、Na2SO3、Na2CO3、Na2SO4的是( )
| A. | BaCl2溶液 | B. | 品红溶液 | C. | 盐酸 | D. | NH4Cl |
6.LiAlH4是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈反应释放出氢气,LiAlH4在125℃分解为LiH、H2和Al.下列叙述错误的是( )
| A. | LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 | |
| B. | LiAlH4与D2O反应,所得氢气的摩尔质量为4 g•mol-1 | |
| C. | 1 mol LiAlH4在125℃完全分解,转移3 mol电子 | |
| D. | LiAlH4与水反应生成三种物质时,化学方程式可表示为:LiAlH4+4H2O═Al(OH)3↓+LiOH+4H2↑ |
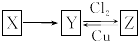 X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):
X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):