题目内容
5.醋酸是一种常见的一元弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质”的实验探究活动.该同学设计了如下方案,其中错误的是( )| A. | 先配制一定量的0.10mol/LCH3COOH溶液,然后测溶液的c(H+),若c(H+)小于0.10mol/L,则可证明醋酸为弱电解质 | |
| B. | 先配制一定量0.0010mol•L-1和0.10mol•L-1的CH3COOH,分别用pH计测它们的c(H+),若前者的c(H+)与后者c(H+)的比值小于10,则可证明醋酸是弱电解质 | |
| C. | 取等体积、等c(H+)的CH3COOH溶液和盐酸分别于足量等规格的锌粒反应,若反应过程中醋酸产生H2较慢且最终产生H2较多,则可证明醋酸是弱电解质 | |
| D. | 取等体积、等c(H+)的CH3COOH溶液和盐酸分别加水稀释相同的倍数,若稀释后CH3COOH溶液中c(H+)大,则可证明醋酸是弱电解质 |
分析 证明醋酸为弱酸的方法有:测一定物质的量浓度醋酸溶液的pH值,测一定物质的量浓度醋酸溶液稀释一定倍数前后溶液的pH,测醋酸钠溶液的pH等.
解答 解:A、0.10mol•L-1CH3COOH溶液,醋酸是一元酸,如果醋酸是强酸,c(H+)等于0.10mol/L,若c(H+)小于0.10mol/L,则证明醋酸是弱电解质,故A正确;
B、0.0010mol•L-1和0.10mol•L-1的CH3COOH,如果醋酸是强酸,溶液的pH分别是3和1,两者的pH相差2个单位,若两者的pH相差小于2个单位,前者的c(H+)与后者c(H+)的比值小于10,则可证明醋酸是弱电解质,故B正确;
C、取等体积、等c(H+)的CH3COOH溶液和盐酸分别于足量等规格的锌粒反应,若反应过程中醋酸产生H2较快且最终产生H2较多,则可证明醋酸是弱电解质,故C错误;
D、取等体积、等c(H+)的CH3COOH溶液和盐酸分别加水稀释相同的倍数,醋酸存在电离平衡,加水稀释促进电离,若稀释后CH3COOH溶液中c(H+)大,则可证明醋酸是弱电解质,故D正确.
故选C.
点评 本题考查酸弱电解质的判断,常见的弱电解质的判断方法有:测一定物质的量浓度溶液的pH,测其常见盐溶液的pH等,注意电离平衡的存在,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列做法一定能增加化学反应速率的是( )
| A. | 增大压强 | B. | 使用合适的催化剂 | ||
| C. | 增多反应物的用量 | D. | 增大反应的温度 |
16.阿斯巴甜是目前使用最广泛的甜味剂.甜度约为蔗糖的200倍,其结构简式为:
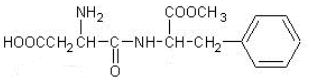
下列关于阿斯巴甜的说法正确的是( )

下列关于阿斯巴甜的说法正确的是( )
| A. | 分子式为C14H19N2O5 | B. | 既能与酸反应又能与碱反应 | ||
| C. | 不能发生水解反应 | D. | 1mol该物质最多可与2molNaOH反应 |
13.关于阿伏伽德罗常数NA,下列叙述正确的是( )
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 1.0L0.1 mol•L-1 AlCl3溶液中所含的Al3+离子数为0.1NA | |
| C. | 标准状况下,11.2LSO3中含有分子数目为0.5NA | |
| D. | 常温常压下,3.2gO2和O3混合气体中含有的氧原子数目为0.2NA |
20.下列各电离方程式中,正确的是( )
| A. | H2CO3?2H++CO32- | B. | Ca(OH)2?Ca2++2OH- | ||
| C. | Fe2(SO4)3?2Fe2++3SO42- | D. | NaHCO3?Na++HCO3- |
10.化学与生产、生活、科技等密切相关,下列说法正确的是( )
| A. | 石油裂解的目的是提高汽油等轻质油的产量和质量 | |
| B. | “神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 | |
| C. | 补血口服液中添加维生素c,作为氧化剂 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 |
17.下列离子方程式中正确的是( )
| A. | 氯气通入冷水中:Cl2+H2O?Cl-+ClO-+2H+ | |
| B. | 亚硫酸氨溶液与足量氢氧化钠溶液反应 HSO3-+OH-═SO32-+H2O | |
| C. | 氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2═HCO3- | |
| D. | 碳酸镁悬浊液中加醋酸 CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
14.下列物质在自然界中能稳定存在的是( )
| A. | 过氧化钠 | B. | 氧化钠 | C. | 碳酸钠 | D. | 氢氧化钠 |