题目内容
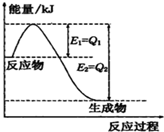 ①一定条件下,N2和H2反应生成lmolNH3过程中能量变化如图所示,则1mol N2完全反应时的焓变为:
①一定条件下,N2和H2反应生成lmolNH3过程中能量变化如图所示,则1mol N2完全反应时的焓变为:②25℃,将a mol?L-1氨水与b mol?L-1盐酸等体积混合,使溶液显中性,则c(NH4+)
用含a、b的代数式表示该混合溶液中氨水的电离平衡常数K=
考点:反应热和焓变,弱电解质在水溶液中的电离平衡
专题:
分析:①Q1和Q2分别代表反应物和生成物的活化能,焓变等于反应物的活化能减去生成物的活化能;
②将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据k=
计算.
②将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据k=
| [NH4+]?[OH-] |
| [NH3?H2O] |
解答:
解:①由图可知,N2和H2反应生成1molNH3的焓变为(Q1-Q2)kJ,该反应的热化学反应方程式为N2(g)+3H2(g)?2NH3(g)△H=2(Q1-Q2)kJ?mol-1,
所以1mol N2完全反应生成2molNH3时的焓变为△H=2(Q1-Q2)kJ?mol-1,故答案为:△H=2(Q1-Q2)kJ?mol-1;
(2)将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,
溶液中c(NH4+)=c(Cl-)=
mol/L,混合后反应前c(NH3?H2O)=
ol/L,则反应后c(NH3?H2O)=(
-
)mol/L,
则k=
=
=
,
故答案为:=;
.
所以1mol N2完全反应生成2molNH3时的焓变为△H=2(Q1-Q2)kJ?mol-1,故答案为:△H=2(Q1-Q2)kJ?mol-1;
(2)将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,
溶液中c(NH4+)=c(Cl-)=
| b |
| 2 |
| a |
| 2 |
| a |
| 2 |
| b |
| 2 |
则k=
| [NH4+]?[OH-] |
| [NH3?H2O] |
| ||||
|
| b×10-7 |
| a-b |
故答案为:=;
| b×10-7 |
| a-b |
点评:本题考查了热化学方程式书写,弱电解质电离平衡的计算应用,沉淀溶解平衡的分析判断,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
化学与人类生产、生活、社会可持续发展密切相关.下列有关说法错误的是( )
| A、在汽车排气管上加装“催化转化器”是为了减少有害气体的排放 |
| B、硬铝属于合金材料,瓷器属于硅酸盐制品 |
| C、食醋可去除水垢,NH4Cl溶液可去除铁锈 |
| D、煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 |
电离常数可以表示弱电解质的电离情况,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):
溶度积常数可以表示难(微)溶物的溶解度情况,下表是常温下几种难(微)溶物的溶度积常数(Ksp):
下列说法正确的是( )
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HF | 3.53×10-4 |
| HCN | 5×10-10 |
| H2SO3 | Ka1=1.54×10-2;Ka2=1.02×10-7 |
| NH3?H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| Mg(OH)2 | 5.61×10-12 |
| MgCO3 | 6.82×10-6 |
| A、酸性:HF>CH3COOH>H2SO3>HCN |
| B、根据溶度积常数(Ksp),甲同学认为除NaCl溶液中少量的MgCl2杂质需要加稍过量的NaOH溶液,而不是Na2CO3溶液;乙同学认为即使在BaSO4悬浊液中加过量的纯碱溶液,BaSO4也不会转化为BaCO3 |
| C、浓度相同的NaCN溶液和HCN的溶液等体积混合,其pH>7,溶液中各离子浓度大小为:c(OH-)>c(H+)>c(Na+)>c(CN-) |
| D、CH3COONH4水溶液显中性,是因为根据电离常数,CH3COO-结合H+与NH4+结合OH-生成弱电解质的程度一样,导致水溶液中的H+与OH-浓度相等 |
同位素示踪法是探究化学反应机理的重要方法,为了验证盐类水解的机理,现设计了两个对照实验,①NH4Cl溶于重水D2O,②将CH3COONa溶于重氧水(H218O),根据你学过的知识,你认为下列说法不正确的是( )
| A、两个示踪试验是为了说明盐类的水解是盐中的弱的离子与水电离出的H+或OH-结合形成弱电解质的过程 |
| B、实验①中,最终同位素D将存在于NH3?DHO、D2O、D+(或D3O+)中 |
| C、实验②中,水解的离子方程式可表示为:CH3COO-+2H218O?CH3COOH+18OH- |
| D、若将NH4Cl溶于H218O和D2O的混合水中,将得到ND3?H218O |
 甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇. A、B、C、D、E五种元素的原子序数依次增大,其中A为周期表中原子半径最小的元素;B原子的最外层电子数是其次外层电子数的2倍;C是地壳中含量最高的元素;Cn-与D+具有相同的电子层结构; E原子的3d能级中成对电子数与未成对电子数之比为4:3.试回答下列问题:
A、B、C、D、E五种元素的原子序数依次增大,其中A为周期表中原子半径最小的元素;B原子的最外层电子数是其次外层电子数的2倍;C是地壳中含量最高的元素;Cn-与D+具有相同的电子层结构; E原子的3d能级中成对电子数与未成对电子数之比为4:3.试回答下列问题:
