题目内容
负载银纳米CeO2可用于光催化降解农药废水,安徽某工厂现用锗(Ge)产品加工废料生产纳米GeO2,实验流程如图.
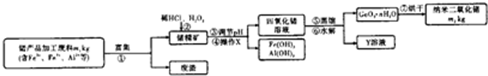
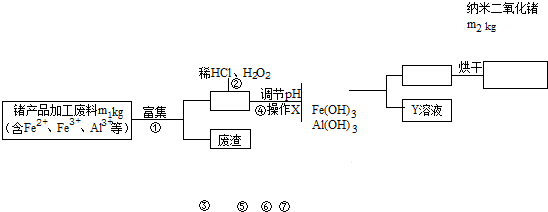
(1)操作X为 .Y溶液是一种在该流程中可循环利用的物质,该物质是 (填化学式).
(2)第②步反应的离子方程式是 .
(3)若要将Fe(OH)3和Al(OH)3分离回收,需要用到的试剂有 (填化学式).
(4)该锗产品加工废料中含锗的质量分数不少于 .


(1)操作X为
(2)第②步反应的离子方程式是
(3)若要将Fe(OH)3和Al(OH)3分离回收,需要用到的试剂有
(4)该锗产品加工废料中含锗的质量分数不少于
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:流程分析锗产品加工废料m1kg含有Fe2+、Fe3+、Al3+,富集过滤得到滤液中加入稀盐酸和过氧化氢溶解后亚铁离子被过氧化氢氧化为铁离子,加入试剂使铁离子和铝离子全部沉淀,锗离子不沉淀,过滤得到四氯化锗溶液,通过蒸馏,水解得到二氧化锗的晶体,烘干得到m2kg纳米二氧化锗;
(1)过滤就是把液体和不溶性的固体分离的一种方法;通过流程图看出盐酸在操作②时还要用到,所以HCl可以循环使用;
(2)Ge元素的化合价升高,则O元素的化合价降低,该反应生成水,以此书写离子反应;
(3)利用氢氧化铝能够和氢氧化钠反应生成可溶性的偏铝酸钠,向偏铝酸钠溶液中通入二氧化碳气体生成氢氧化铝的性质分离;
(4)质量为m2的纳米GeO2中Ge的质量m=
m2,故该锗产品加工废料中含锗的质量分数不少于
×100%;
(1)过滤就是把液体和不溶性的固体分离的一种方法;通过流程图看出盐酸在操作②时还要用到,所以HCl可以循环使用;
(2)Ge元素的化合价升高,则O元素的化合价降低,该反应生成水,以此书写离子反应;
(3)利用氢氧化铝能够和氢氧化钠反应生成可溶性的偏铝酸钠,向偏铝酸钠溶液中通入二氧化碳气体生成氢氧化铝的性质分离;
(4)质量为m2的纳米GeO2中Ge的质量m=
| 73 |
| 105 |
| 73m2 |
| 105m1 |
解答:
解:(1)通过流程图看出经过操作x分成了四氯化碳溶液和难溶性的Fe(OH)3和Al(OH)3,操作X为过滤;通过流程图看出盐酸在操作②时还要用到,所以HCl可以循环使用,故答案为:过滤;HCl;
(2)Ge元素的化合价升高,则O元素的化合价降低,该反应生成水,该离子反应为Ge2++H2O2+2H+=Ge4++2H2O,
故答案为:Ge2++H2O2+2H+=Ge4++2H2O;
(3)Fe(OH)3不能溶解在碱性溶液中,Al(OH)3可以和NaOH反应生成偏铝酸钠,Al(OH)3十NaOH=NaAlO2十2H2O,NaAlO2再与二氧化碳反应生成Al(OH)3,
2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3;
故答案为:NaOH、CO2;
(4)质量为m2的纳米GeO2中Ge的质量m=
m2,故该锗产品加工废料中含锗的质量分数不少于
×100%=
×100%;
故答案为:
×100%.
(2)Ge元素的化合价升高,则O元素的化合价降低,该反应生成水,该离子反应为Ge2++H2O2+2H+=Ge4++2H2O,
故答案为:Ge2++H2O2+2H+=Ge4++2H2O;
(3)Fe(OH)3不能溶解在碱性溶液中,Al(OH)3可以和NaOH反应生成偏铝酸钠,Al(OH)3十NaOH=NaAlO2十2H2O,NaAlO2再与二氧化碳反应生成Al(OH)3,
2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3;
故答案为:NaOH、CO2;
(4)质量为m2的纳米GeO2中Ge的质量m=
| 73 |
| 105 |
| ||
| m1 |
| 73m2 |
| 105m1 |
故答案为:
| 73m2 |
| 105m1 |
点评:本题考查制备实验方案的设计,涉及氧化还原反应、离子反应、难溶电解质的溶解平衡、两性氧化物等知识,综合性较强,题目难度较大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
在制水泥、制玻璃、炼铁三种工业生产中,都需要的原料是( )
| A、纯碱 | B、石灰石 |
| C、粘土 | D、生石灰 |
下列实验装置,试剂选用或操作正确的是( )


| A、除去NO中的NO2 |
| B、干燥Cl2 |
| C、稀释浓硫酸 |
| D、制备少量O2 |
下列有关说法正确的是( )
| A、李比希法、钠熔法、铜丝灼烧法等都是定量研究有机物中元素组成的方法 |
| B、元素分析仪可用于分析有机物中的元素组成 |
| C、“钠熔法”的变化过程中钠必定发生还原反应 |
| D、根据1H核磁共振谱就可以确定任何有机物分子的结构 |
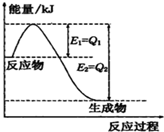 ①一定条件下,N2和H2反应生成lmolNH3过程中能量变化如图所示,则1mol N2完全反应时的焓变为:
①一定条件下,N2和H2反应生成lmolNH3过程中能量变化如图所示,则1mol N2完全反应时的焓变为: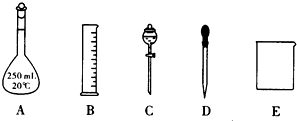
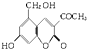 ,它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题:
,它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题: