题目内容
电离常数可以表示弱电解质的电离情况,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):
溶度积常数可以表示难(微)溶物的溶解度情况,下表是常温下几种难(微)溶物的溶度积常数(Ksp):
下列说法正确的是( )
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HF | 3.53×10-4 |
| HCN | 5×10-10 |
| H2SO3 | Ka1=1.54×10-2;Ka2=1.02×10-7 |
| NH3?H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| Mg(OH)2 | 5.61×10-12 |
| MgCO3 | 6.82×10-6 |
| A、酸性:HF>CH3COOH>H2SO3>HCN |
| B、根据溶度积常数(Ksp),甲同学认为除NaCl溶液中少量的MgCl2杂质需要加稍过量的NaOH溶液,而不是Na2CO3溶液;乙同学认为即使在BaSO4悬浊液中加过量的纯碱溶液,BaSO4也不会转化为BaCO3 |
| C、浓度相同的NaCN溶液和HCN的溶液等体积混合,其pH>7,溶液中各离子浓度大小为:c(OH-)>c(H+)>c(Na+)>c(CN-) |
| D、CH3COONH4水溶液显中性,是因为根据电离常数,CH3COO-结合H+与NH4+结合OH-生成弱电解质的程度一样,导致水溶液中的H+与OH-浓度相等 |
考点:弱电解质在水溶液中的电离平衡,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:A、对于一元弱酸,电离平衡常数越大则酸性越强;
B、可以根据硫酸钡、碳酸钡的溶解度计算出使SO42-物质的量浓度不小于0.01mol?L-1,则溶液中CO32-物质的量浓度;
C、水解是微弱的,盐类水解产生的离子浓度远远小于其自身电离出来的离子浓度;
D、醋酸与一水合氨的电离平衡常数相同,说明醋酸根离子和铵根离子的水解程度相同;
B、可以根据硫酸钡、碳酸钡的溶解度计算出使SO42-物质的量浓度不小于0.01mol?L-1,则溶液中CO32-物质的量浓度;
C、水解是微弱的,盐类水解产生的离子浓度远远小于其自身电离出来的离子浓度;
D、醋酸与一水合氨的电离平衡常数相同,说明醋酸根离子和铵根离子的水解程度相同;
解答:
解:A、对于一元弱酸,电离平衡常数越大则酸性越强,所以,酸性有强到弱的顺序为:H2SO3>HF>CH3COOH>HCN,故A错误;
B、在BaSO4悬浊液中加过量的纯碱溶液,碳酸根离子浓度与钡离子浓度乘积变大,大于其Ksp时,BaSO4可以转化为BaCO3,故B错误;
C、浓度相同的NaCN溶液和HCN的溶液等体积混合,其pH>7,说明NaCN的水解程度大于HCN的电离程度,但水解毕竟是微弱的,离子浓度应为c(Na+)>c(CN-)>c(OH-)>c(H+),故C错误;
D、醋酸与一水合氨的电离平衡常数相同,说明醋酸根离子和铵根离子的水解程度相同,即CH3COO-结合H+与NH4+结合OH-生成弱电解质的程度一样,导致水溶液中的H+与OH-浓度相等,故D正确;
故选D.
B、在BaSO4悬浊液中加过量的纯碱溶液,碳酸根离子浓度与钡离子浓度乘积变大,大于其Ksp时,BaSO4可以转化为BaCO3,故B错误;
C、浓度相同的NaCN溶液和HCN的溶液等体积混合,其pH>7,说明NaCN的水解程度大于HCN的电离程度,但水解毕竟是微弱的,离子浓度应为c(Na+)>c(CN-)>c(OH-)>c(H+),故C错误;
D、醋酸与一水合氨的电离平衡常数相同,说明醋酸根离子和铵根离子的水解程度相同,即CH3COO-结合H+与NH4+结合OH-生成弱电解质的程度一样,导致水溶液中的H+与OH-浓度相等,故D正确;
故选D.
点评:本题考查了弱电解质的电离平衡常数和沉淀的离子积常数的相关知识,题目难度不大.

练习册系列答案
相关题目
下列有关物质性质的比较中,正确的是( )
①沸点:H2O>HCl>HF
②密度:四氯化碳>水>汽油
③酸性:H3PO4>H2SO4>HClO4
④离子半径:O2->F->Na+.
①沸点:H2O>HCl>HF
②密度:四氯化碳>水>汽油
③酸性:H3PO4>H2SO4>HClO4
④离子半径:O2->F->Na+.
| A、①③ | B、②④ | C、①④ | D、②③ |
警察常从案发现场的人体气味来获取有用线索,人体气味的成分中含有以下化合物:①辛酸;②壬酸;③环十二醇;④5,9?十一烷酸内酯;⑤十八烷;⑥己醛;⑦庚醛.下列说法正确的是( )
| A、①、②、⑥、⑦分子中碳原子数小于10 |
| B、①、②是无机物,③、⑤、⑦是有机物 |
| C、①是酸性化合物,②不是酸性化合物 |
| D、②、③、④含氧元素,⑤、⑥、⑦不含氧元素 |
分类思想是学习化学的重要思想,从分类的角度分析正确的是( )
| A、SO2和NO2溶于水都显酸性,因而它们都是酸性氧化物 |
| B、Na2O和NH3的水溶液均能导电,故均为电解质 |
| C、Si和SiO2均属于原子晶体 |
| D、Na2O和Na2O2与水反应均会生成强碱,故都是碱性氧化物 |
下列实验装置,试剂选用或操作正确的是( )


| A、除去NO中的NO2 |
| B、干燥Cl2 |
| C、稀释浓硫酸 |
| D、制备少量O2 |
 研究碳及其化合物的性质和用途是中学化学的任务之一.
研究碳及其化合物的性质和用途是中学化学的任务之一.
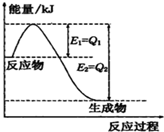 ①一定条件下,N2和H2反应生成lmolNH3过程中能量变化如图所示,则1mol N2完全反应时的焓变为:
①一定条件下,N2和H2反应生成lmolNH3过程中能量变化如图所示,则1mol N2完全反应时的焓变为: