题目内容
16.下列说法正确的是( )| A. | 用 HNO2溶液作导电性实验,灯光较暗,说明 HNO2是弱电解质 | |
| B. | NaCl 溶液和 CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 25℃时,用醋酸溶液中和等浓度 NaOH 溶液至 pH=7,VCH3COOH<VNaOH | |
| D. | AgCl 易转化为 AgI 沉淀且 Ksp(AgX)=[Ag+]•[X-],故 Ksp(AgI)<Ksp(AgCl) |
分析 A.电解质强弱是根据电解质电离程度划分的,电解质溶液导电性强弱与离子浓度及离子所带电荷有关;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离;
C.醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使醋酸和NaOH混合溶液呈中性,则醋酸应该稍微过量;
D.溶度积常数表达式相同时,溶度积常数大的物质能转化为溶度积常数小的物质.
解答 解:A.电解质强弱是根据电解质电离程度划分的,电解质溶液导电性强弱与离子浓度及离子所带电荷有关,用 HNO2溶液作导电性实验,灯光较暗,说明 HNO2溶液中离子浓度小,但不能说明亚硝酸部分电离,所以不能证明亚硝酸是弱电解质,故A错误;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离,NaCl是强酸强碱盐,不影响水的电离,醋酸氨是弱酸弱碱盐,促进水电离,所以两种溶液中水的电离程度前者小于后者,故B错误;
C.醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使醋酸和NaOH混合溶液呈中性,则醋酸应该稍微过量,二者浓度相对,所以VCH3COOH>VNaOH,故C错误;
D.溶度积常数表达式相同时,溶度积常数大的物质能转化为溶度积常数小的物质,AgCl、AgI溶度积常数表达式相同,AgCl 易转化为 AgI 沉淀,所以 Ksp(AgI)<Ksp(AgCl),故D正确;
故选D.
点评 本题考查较综合,涉及难溶物的转化、酸碱中和定性判断、水的电离、强弱电解质判断等知识点,明确实验原理、物质性质是解本题关键,注意:溶液导电性强弱与电解质强弱无关,易错选项是A.

练习册系列答案
相关题目
5.下列说法正确的是( )
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1,则H2燃烧热(△H)为-241.8kJ•mol-1 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.6molH2SO4的稀硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 由BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ•mol-1①BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1②可得反应C(s)+CO2(g)=2CO(g)的△H=+172.5kJ•mol-1 |
7.下列说法正确的是( )
| A. | 向稀的Na2CO3和NaHCO3溶液中加入CaCl2溶液均有白色沉淀产生 | |
| B. | 向Al2(SO4)3溶液中逐滴滴入NaOH溶液与向NaOH溶液中逐滴滴入Al2(SO4)3溶液,产生的现象相同 | |
| C. | 等质量的Al分别与过量的NaOH、HCl溶液反应,NaOH溶液中放出的H2多 | |
| D. | 分别向Na2CO3和NaHCO3溶液中滴加澄清石灰水,都能生成白色沉淀 |
11.下列关于硅的化学性质的叙述,正确的是( )
| A. | 常温时不和任何酸反应 | B. | 常温时可和强碱溶液反应 | ||
| C. | 单质硅比碳的还原性弱 | D. | 单质硅比碳的氧化性强 |
1.烯烃在一定条件下发生氧化反应时C=C键发生断裂,如RCH=CHR’,可以氧化成RCHO和R’CHO,在该条件下,下列烯烃分别被氧化后产物可能有乙醛的是( )
| A. | CH3CH=CH(CH2)2CH3 | B. | CH2=CH(CH2)2CH3 | ||
| C. | CH3CH2 CH=CH2 | D. | CH3CH2CH=CHCH2CH3 |
8.t℃时某Ba(OH)2稀溶液中,c(H+)=10-xmol•L-1、c(OH-)=10-ymol•L-1,且x+y=16.向该溶液中逐滴加入pH=m的盐酸,t℃下测得混合液的pH如下表所示(假设混合时体积变化忽略不计),则m、n分别为( )
| 序号 | Ba(OH)2溶液体积/mL | 盐酸体积/mL | 混合液pH |
| 1 | 22.00 | 0 | 10 |
| 2 | 22.00 | 22.00 | 8 |
| 3 | 22.00 | 18.00 | n |
| A. | 4、9 | B. | 4、7 | C. | 6、9 | D. | 6、7 |
5.下列电离方程式不正确的是( )
| A. | NaHCO3═Na++HCO3- | B. | NaHSO4═Na++H++SO42- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | H3PO4?3H++PO43- |
6.设NA表示阿伏加德罗常数的值.下列说法不正确的是( )
| A. | 标准状况下,2.24 L甲醛中含氧原子数目为0.1NA | |
| B. | 常温下,28g C2H4含NA个碳碳双键 | |
| C. | 常温常压下,1 mol羟基所含的电子数为9NA | |
| D. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA |
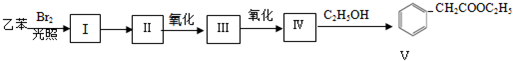
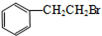 .
. .
.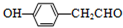 .
.