题目内容
5.下列说法正确的是( )| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1,则H2燃烧热(△H)为-241.8kJ•mol-1 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.6molH2SO4的稀硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 由BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ•mol-1①BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1②可得反应C(s)+CO2(g)=2CO(g)的△H=+172.5kJ•mol-1 |
分析 A、燃烧热是指1mol燃料完全燃烧生成稳定的化合物,H2的燃烧热为1mol氢气完全燃烧生成液体水时放出的热量;
B、含0.6molH2SO4的稀硫酸与含1molNaOH的溶液混合,会产生1mol的水,据此判断反应热;
C、物质具有的能量越低越稳定;
D、根据盖斯定律进行方程式焓变的计算.
解答 解:A、燃烧热是指1mol燃料完全燃烧生成稳定的化合物,H2的燃烧热为1mol氢气完全燃烧生成液体水时放出的热量,不能生成气态的水,所以H2燃烧热(△H)不是-241.8kJ•mol-1,故A错误;
B、在若将含0.6molH2SO4的稀硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ,故B错误;
C、已知C(石墨,s)═C(金刚石,s)△H>0,所以石墨能量低于金刚石具有的能量,此证明金刚石不如石墨稳定;
D、由BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ•mol-1①;
BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1②,根据盖斯定律:$\frac{①-②}{2}$可得反应:C(s)+CO2(g)=2CO(g),解得△H=+172.5kJ•mol-1
,故D正确.
故选D.
点评 本题考查了热化学方程式的含义、书写、盖斯定律的应用,理解溶解热和电离过程中的能量改变是解题的关键.

练习册系列答案
相关题目
16.下列反应的离子方程式中,正确的是( )
| A. | 铜粉放入硝酸银溶液里:Cu+Ag+═Cu2++Ag | |
| B. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 澄清石灰水与稀盐酸反应:OH-+H+═H2O | |
| D. | 硫酸铜溶液和氢氧化钠溶液反应:CuSO4+2OH-═Cu(OH)2↓+SO42- |
20.溶液中可以大量共存的一组离子是( )
| A. | Al3+、Na+、OH-、Cl- | B. | H+、AlO2-、Na+、SO42- | ||
| C. | Mg2+、AlO2-、Al3+、NO3- | D. | OH-、AlO2-、K+、Na+ |
10.设NA为阿伏加罗常数的值,下列叙述正确的是( )
| A. | 在标况下,11.2 L NO与11.2 L O2混合后所含分子数为0.75NA | |
| B. | 常温常压下,16gO3所含的电子数为8NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA | |
| D. | 铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA |
17.四种短周期元素在周期表中的位置如图,其中M为地壳中含量最高的金属元素.下列说法不正确的是( )
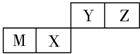

| A. | 原子半径Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| C. | X的最简单气态氢化物的热稳定性比Z的弱 | |
| D. | Z位于元素周期表中第2周期、第ⅥA族 |
16.下列说法正确的是( )
| A. | 用 HNO2溶液作导电性实验,灯光较暗,说明 HNO2是弱电解质 | |
| B. | NaCl 溶液和 CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 25℃时,用醋酸溶液中和等浓度 NaOH 溶液至 pH=7,VCH3COOH<VNaOH | |
| D. | AgCl 易转化为 AgI 沉淀且 Ksp(AgX)=[Ag+]•[X-],故 Ksp(AgI)<Ksp(AgCl) |
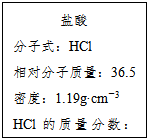 如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题: