题目内容
18.设NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 3.2g S在反应中转移电子数为0.2NA | |
| B. | 0.1mol Fe在反应中转移电子数为0.3NA | |
| C. | 6.5g Zn在反应中转移电子数为0.2NA | |
| D. | 11.2L O2在反应中转移电子数为0.2NA |
分析 A、硫反应后可能变为-2价,也可能变为-1价;
B、铁反应后可能变为+3价,还可能变为+2价;
C、求出锌的物质的量,然后根据锌反应后变为+2价来分析;
D、氧气所处的状态不明确.
解答 解:A、硫反应后可能变为-2价,也可能变为-1价,故3.2g硫即0.1mol硫转移的电子数可能为0.2NA个,还可能为0.1NA个,故A错误;
B、铁反应后可能变为+3价,还可能变为+2价,故0.1mol铁转移的电子数可能为0.3NA个,还可能为0.2NA个,故B错误;
C、6.5g锌的物质的量为0.1mol,而锌反应后变为+2价,故0.1mol锌转移0.2NA个电子,故C正确;
D、氧气所处的状态不明确,故其物质的量无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
8.在某温度下,将2molA和3molB充入密闭容器中发生反应:aA(g)+B(g)═C(g)+D(g),5min后达到平衡(己知该反应的化学平衡常数为1).保持温度不变.将容器体积扩大10了倍,A 的转化率不变.则B的转化率为( )
| A. | 60% | B. | 40% | C. | 24% | D. | 4% |
13.如图是立方烷的球棍模型,下列有关说法不正确的是( )


| A. | 它的一氯代物只有一种同分异构体 | |
| B. | 它的二氯代物有两种同分异构体 | |
| C. | 它的分子式为C8H8 | |
| D. | 它与苯乙烯(C6H5-CH=CH2)互为同分异构体 |
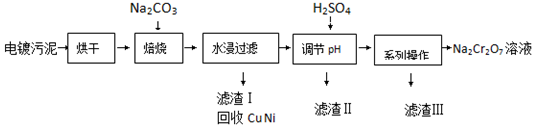
3.电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过下述流程回收Na2Cr2O7等物质.
已知:
①Cr(OH)3、ZnO和Al2O3一样均为两性化合物;
②Na2Cr2O7、Na2SO4在不同温度下的溶解度如表:
(1)焙烧过程中生成Na2CrO4的化学方程式为4Cr(OH)3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+6H2O+4CO2;水浸后溶液中除Na2CrO4还存在的溶质有NaAlO2和Na2ZnO2;
(2)加入H2SO4调节pH的目的为除去溶液中NaAlO2、Na2ZnO2杂质,并将CrO42-转化为Cr2O72-;
(3)得到滤渣Ⅲ的“系列操作”的步骤为蒸发浓缩、冷却结晶 过滤;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g,CrO42-有8/9转化为Cr2O72-,求转化后所得溶液中c(Cr2O72-)=0.2mol•L-1;
(5)向Na2Cr2O7与H2SO4混合液中加入H2O2,再加入乙醚并摇动,乙醚层为蓝色.乙醚中溶有CrO5,则发生反应的化学方程式为Na2Cr2O7+4H2O2+H2SO4═2CrO5+Na2SO4+5H2O.

已知:
①Cr(OH)3、ZnO和Al2O3一样均为两性化合物;
②Na2Cr2O7、Na2SO4在不同温度下的溶解度如表:
| 20℃ | 60℃ | 100℃ | |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
(2)加入H2SO4调节pH的目的为除去溶液中NaAlO2、Na2ZnO2杂质,并将CrO42-转化为Cr2O72-;
(3)得到滤渣Ⅲ的“系列操作”的步骤为蒸发浓缩、冷却结晶 过滤;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g,CrO42-有8/9转化为Cr2O72-,求转化后所得溶液中c(Cr2O72-)=0.2mol•L-1;
(5)向Na2Cr2O7与H2SO4混合液中加入H2O2,再加入乙醚并摇动,乙醚层为蓝色.乙醚中溶有CrO5,则发生反应的化学方程式为Na2Cr2O7+4H2O2+H2SO4═2CrO5+Na2SO4+5H2O.