题目内容
3.将5mL、0.10mol•L-1的H2SO3溶液与10mol 0.10mol•L-1的NaOH溶液混合,写出反应的离子方程式:H2SO3+2OH-═SO32-+2H2O.分析 亚硫酸为二元弱酸,根据n=cV分别计算出两溶液中含有亚硫酸、氢氧化钠的物质的量,然后判断过量情况及反应产物,最后写出反应的离子方程式.
解答 解:5mL、0.10mol•L-1的H2SO3溶液中含有亚硫酸的物质的量为:0.10mol/L×0.005L=0.0005mol,
10mol 0.10mol•L-1的NaOH溶液中含有氢氧化钠的物质的量为:0.10mol/L×0.01L=0.001mol,
两溶液混合后恰好反应生成亚硫酸钠和水,反应的离子方程式为:H2SO3+2OH-═SO32-+2H2O,
故答案为:H2SO3+2OH-═SO32-+2H2O.
点评 本题考查了离子方程式的书写,题目难度不大,明确反应物过量情况对生成物的影响为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
13.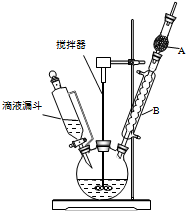 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
已知:①过程中生成的中间物质格氏试剂易发生水解反应;
②部分相关物质的沸点如下:
③三苯甲醇的相对分子质量为260.
请回答下列问题:
(1)装置中玻璃仪器B的名称为冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持温度约为40℃,可以采用水浴加热方式.
(3)制得的三苯甲醇粗产品中含有乙醚、溴苯、氯化铵等杂质,可以设计如下提纯方案:
粗产品$\stackrel{①操作}{→}$$\stackrel{②溶解、过滤}{→}$$\stackrel{③洗涤、干燥}{→}$三苯甲醇,其中,操作①的名称是蒸馏或分馏;洗涤液最好选用a(填字母序号).
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL.则产品中三苯甲醇的质量分数为90%.
 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.已知:①过程中生成的中间物质格氏试剂易发生水解反应;
②部分相关物质的沸点如下:
| 物质 | 沸点/℃ |
| 三苯甲醇[ | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
请回答下列问题:
(1)装置中玻璃仪器B的名称为冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持温度约为40℃,可以采用水浴加热方式.
(3)制得的三苯甲醇粗产品中含有乙醚、溴苯、氯化铵等杂质,可以设计如下提纯方案:
粗产品$\stackrel{①操作}{→}$$\stackrel{②溶解、过滤}{→}$$\stackrel{③洗涤、干燥}{→}$三苯甲醇,其中,操作①的名称是蒸馏或分馏;洗涤液最好选用a(填字母序号).
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL.则产品中三苯甲醇的质量分数为90%.
14.在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
| A. | H+、Ba2+、Cl-、NO3- | B. | K+、AlO2-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Fe3+、NH4+、SCN-、Cl- |
11.某人按下列方法测定样品中Na2O2的含量:城区一定量样品溶于足量的水,Na2O2+2H2O═2NaOH+H2O2,H2O2$\frac{\underline{\;NaOH\;}}{\;}$H2O+$\frac{1}{2}$O2.根据生成O2的量计算样品中Na2O2的纯度,他仔细实验多次,得到Na2O2含量均明显低于实际含量,这是因为( )
| A. | 称量错误 | |
| B. | H2O2分解不完全 | |
| C. | Na2O2转化为Na0H和H2O2的反应不完全 | |
| D. | 装置漏气 |
18.下列各组离子能大量共存的是( )
| A. | H+、NH4+、I-、Fe3+ | B. | K+、Ag+、Cl-、NO3- | ||
| C. | ClO-、Fe2+、SO42-、Na+ | D. | Ba2+、Na+、OH-、Br- |
1.有X,Y,Z三种物质,把过量的X与Y共热,有气体产生,把该气体通入少量Z的溶液中,会产生白色沉淀,则X,Y,Z可能是( )
| A. | 浓硫酸 NaCl+MnO2 AgNO3 | B. | NaOH溶液 Ca(HCO3)2 Ca(OH)2 | ||
| C. | NaOH溶液 (NH4)2SO4 KAl(SO4)2 | D. | 浓硫酸 NaCl H2S |
19.下列图示与对应的叙述相符的是( )
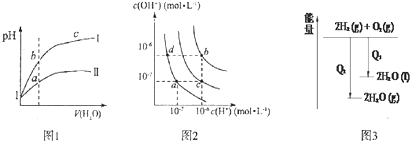

| A. | 图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 | |
| B. | 图2中纯水仅升高温度,就可以从a点变到c点 | |
| C. | 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 | |
| D. | 图3表示氢气与氧气反应中的能量变化 |