题目内容
14.在溶液中加入足量Na2O2后仍能大量共存的离子组是( )| A. | H+、Ba2+、Cl-、NO3- | B. | K+、AlO2-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Fe3+、NH4+、SCN-、Cl- |
分析 Na2O2具有强氧化性,能和水反应生成氢氧化钠和氧气,加入足量Na2O2后仍能大量共存,说明离子不具有强还原性,且与OH-不反应,
A.氢离子与氢氧根离子反应;
B.四种离子之间不反应,加入过氧化钠后仍然不反应;
C.钙离子、镁离子、碳酸氢根离子都与氢氧根离子反应;
D.铁离子、铵根离子与氢氧根离子反应,铁离子与硫氰根离子发生络合反应.
解答 解:Na2O2具有强氧化性,能和水反应生成氢氧化钠和氧气,加入足量Na2O2后仍能大量共存,说明离子不具有强还原性,且与OH-不反应,
A.H+与氢氧根离子反应,加入过氧化钠后不能大量共存,故A错误;
B.K+、AlO2-、Cl-、SO42-之间不反应,加入过氧化钠后也不反应,在溶液中能够大量共存,故B正确;
C.Ca2+、Mg2+、HCO3-与氢氧根离子反应,加入过氧化钠后不能大量共存,故C错误;
D.Fe3+、NH4+与氢氧根离子反应,Fe3+、SCN-之间发生络合反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,“加入足量Na2O2后仍能大量共存”说明离子不具有强还原性,且与OH-不反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.某有机物的结构简式如图所示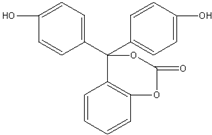 ,下列有关该有机物的说法不正确的是( )
,下列有关该有机物的说法不正确的是( )
 ,下列有关该有机物的说法不正确的是( )
,下列有关该有机物的说法不正确的是( )| A. | 该有机物的化学式为C20H14O5 | |
| B. | 该有机物分子中的三个苯环不可能共平面 | |
| C. | 该有机物可发生加成反应、取代反应、氧化反应 | |
| D. | 1mol该有机物与足量NaOH溶液充分反应,参加反应的NaOH的物质的量为6mol |
19.将含有0.400mol CuSO4和0.200mol FeCl3水溶液1L,用惰性电极电解一段时间后在电极上析出19.2g Cu,此时在另一电极上放出的气体在标状况下的体积为( )
| A. | 5.60L | B. | 6.72L | C. | 4.48L | D. | 7.84L |
6.常温下,氮的氧化物(NOx)中除五氧化二氮为固体外,其余均为气体.五氧化二氮的熔点为30℃,则等质量的N2O、N0、N2O5三种物质在常温下体积的大小顺序是( )
| A. | N2O>NO>N2O5 | B. | NO>N2O>N2O5 | C. | N2O5>NO>N2O | D. | N2O5>N2O>NO |
10.海水中含有多种元素,开发利用这些资源是科学研究的重要课题.图为海水利用的部分过程,下列有关说法正确的是( )
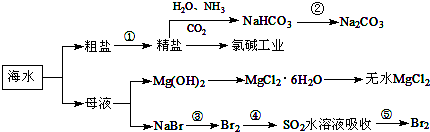

| A. | 要实现反应②可向NaHCO3溶液中加入过量石灰水 | |
| B. | 氯碱工业中采用阴离子交换膜提高产品纯度 | |
| C. | MgCl2溶液加热蒸干可得无水MgCl2 | |
| D. | 溴元素在反应③、⑤中均被氧化,在反应④中被还原 |