题目内容
3.硫酸是中学最常见的三大强酸之一,某研究性学习小组探究外界条件对铁与硫酸反应速率的影响.[实验设计]控制用同种铁块,初始使用硫酸体积均为1000mL,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验.
(1)请完成以下实验设计表(表中不要留空格).
| 实验 编号 | 实验目的 | T/K | Fe/g | c(H2SO4)/mol•L-1 |
| ① | 为以下实验作参考 | 298 | 10 | 1.0 |
| ② | 探究温度对反应速率的影响 | |||
| ③ | 298 | 10 | 18.4 |
(2)实验①、②表明温度越高,反应速率越快
请再提出一种加快该反应速率的方法增大同质量铁的表面积或加入少量硫酸铜,构成原电池
(3)实验③得出的结论是:当硫酸浓度为18.4mol/L,反应速率趋向于零(反应速率趋向于停止),原因是常温下,铁与浓硫酸发生钝化
[思考与交流]
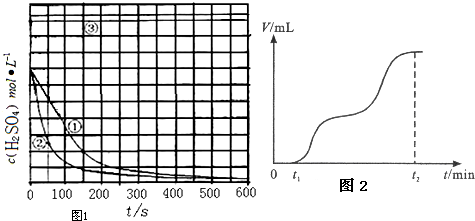
(4)实验③,若t1时开始加热,在铁的表面逐渐产生气泡,当有大量气泡产生时,控制反应温度基本不变.甲同学将收集到的气体体积与时间的关系粗略地表示为图2.t1~t2时间段,反应生成的气体是SO2、H2.写出开始加热时发生反应的化学方程式:2Fe+6H2SO4(浓)═Fe2(SO4)3+3SO2↑+6H2O.
分析 (1)探究温度对反应速率的影响,做对比实验时要求其他条件要完全相同,所以从表中数据可分析得出实验②的数据,实验③中只有硫酸的浓度与第①个实验不同,便可分析出实验目的;
(2)实验①和②对比的温度,根据温度对反应速率的影响分析;要加快反应速率,方法有增大同质量铁的表面积或加入少量硫酸铜,构成原电池;
(3)当硫酸浓度为18.4mol/L,反应的本质发生了改变,铁和浓硫酸发生钝化,不再产生氢气进行分析;
(4)根据铁和浓硫酸发生钝化是因为浓硫酸的强氧化性,加热后钝化失效,铁和浓硫酸在加热的条件下反应,产生的气体是二氧化硫,随着反应的进行,浓硫酸变成稀硫酸,铁与稀硫酸反应产生氢气进行分析.
解答 解:(1)探究温度对反应速率的影响,作对比实验时要求其他条件要完全相同,所以从表中数据可分析得出实验②的数据,温度是313K,铁的质量和硫酸的浓度应和实验①相同;实验③中只有硫酸的浓度与第①个实验不同,得出实验目的是:探究硫酸浓度对反应速率的影响,故答案为:
| 实验 编号 | 实验目的 | T/K | Fe/g | c(H2SO4)/mol•L-1 |
| ① | ||||
| ② | 313 | 10 | 1.0 | |
| ③ | 探究硫酸浓度对反应速率的影响 |
故答案为:温度越高,反应速率越快;增大同质量铁的表面积或加入少量硫酸铜,构成原电池;
(3)常温下,当硫酸浓度为18.4mol/L,反应的本质发生了改变,铁和浓硫酸发生钝化,不再产生氢气,反应速率趋向于零(反应速率趋向于停止),
故答案为:反应速率趋向于零(反应速率趋向于停止);常温下,铁与浓硫酸发生钝化;
(4)常温下,铁和浓硫酸发生钝化,加热后钝化失效,由于浓硫酸的强氧化性,铁和浓硫酸在加热的条件下反应产生的气体是二氧化硫,
方程式为:2Fe+6H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O,随着反应的进行,浓硫酸变成稀硫酸,铁与稀硫酸反应产生氢气,
故答案为:SO2、H2;2Fe+6H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O.
点评 本题考查外界条件对化学反应速率影响的探究,注意对比实验中条件的统一,浓硫酸与稀硫酸性质的区别是常考的知识,要特别注意,题目难度适中.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案
相关题目
19.下列分子式表示的有机物中,含单官能团的同分异构体数目最多的是( )
| A. | C4H8 | B. | C4H7Cl | C. | C4H8O | D. | C4H10O |
20.下列有关元素周期表的说法中不正确的是( )
| A. | 氢处于第一周期 | B. | 第三周期元素全部是金属元素 | ||
| C. | 第二周期共有8种元素 | D. | 氯处于VⅡA族 |
4.下列各组物质中一定互为同系物的是( )
| A. | C3H4;C5H8 | B. | C3H8;C5H12 | ||
| C. | CH3-CH2-CH2-CH3 ; | D. | C2H5Cl;C3H6Cl2 |
13.现在电池的种类非常多,且由电池造成的污染越来越严重,下列电池不会造成环境污染的是( )
| A. | 碱性锌锰电池 | B. | 氢氧燃料电池 | C. | 酸性锌锰电池 | D. | 镍镉电池 |