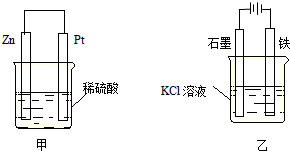
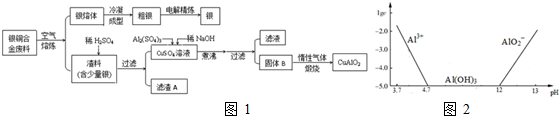
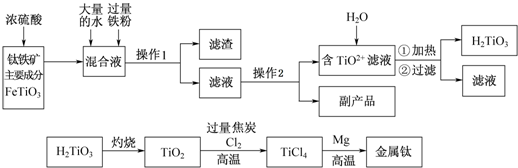
题目内容
10.某无色溶液中可能含有Na+、K+、Fe3+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①pH试纸检验,溶液的pH>7.
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成.
③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液.
④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤.
⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生.
则关于原溶液的判断中不正确的是( )
| A. | 肯定不存在的离子是Fe3+、Cu2+、SO42-、CO32- | |
| B. | 肯定存在的离子是Na+、K+、SO32-、Br-、Cl- | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤 ④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 |
分析 ①pH试纸检验,溶液的pH>7,证明溶液显示碱性,②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成,则一定不存在硫酸根离子,③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,则为溴水的颜色,一定不含有碳酸根离子,④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,可以证明亚硫酸根离子的存在,⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生,即为氯化银沉淀.
解答 解:某无色溶液中一定不存在:Fe3+、Cu2+,①pH试纸检验,溶液的pH>7,证明溶液显示碱性,一定含有钠离子或是钾离子中的至少一种,②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成,则一定不存在硫酸根离子,③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,则一定不含CO32-,可能含有SO32-,亚硫酸根能被溴水氧化为硫酸根离子,再加入CCl4振荡,静置后CCl4层呈橙色,则为溴水的颜色,一定含有溴离子,④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,可以证明硫酸根离子的存在,即是亚硫酸根被氧化生成的硫酸根离子,一定不存在铵根离子,因为二者会双水解而不共存,⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生,即为氯化银沉淀,但是在③中加入的氯水中含有氯离子,不能确定是否存在待测离子中的氯离子.
A、肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32-,故A正确;
B、肯定存在的离子是SO32-、Br-,还有Na+、K+中的至少一种,故B错误;
C、在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生,即为氯化银沉淀,但是在③中加入的氯水中含有氯离子,不能确定是否存在待测离子中的氯离子,故C正确;
D、若步骤④改用BaCl2溶液和盐酸的混合溶液,则硫酸根离子会和BaCl2溶液反应生成难溶物质硫酸钡,但是硫酸根一定是亚硫酸根离子被氧化来的,此时对溶液中离子的判断无影响,故D正确.
故选B.
点评 本题考查离子的检验,物质的检验是化学的重难点,也是考试的热点之一,了解物质或离子的化学性质是本题解题的关键,综合性较强,难度大.

 名校课堂系列答案
名校课堂系列答案| A. | 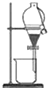 用于分离水和乙醇的混合物 | |
| B. | 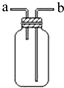 可用于H2,NH3,CO2,Cl2,HCl,NO2等气体收集 | |
| C. | 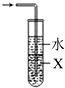 当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 | |
| D. | 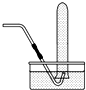 常用于实验室收集氧气、氢气等 |
| A. | C3H4;C5H8 | B. | C3H8;C5H12 | ||
| C. | CH3-CH2-CH2-CH3 ; | D. | C2H5Cl;C3H6Cl2 |
(已知:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O)
| 试管编号 | 3% Na2S2O3溶液 | H2O | 稀H2SO4(体积比为1:5) | 出现浑浊时间 |
| ① | 3mL | 3mL | 5滴 | 33s |
| ② | 4mL | 2mL | 5滴 | 28s |
| ③ | 5mL | 1mL | 5滴 | cs |
(1)②中加3% Na2S2O3溶液4 mL.
(2)测得中出现浑浊的时间可能是c(填字母). a.42s b.30s c.16s
(3)上述实验结论是对于一个化学反应,在其他条件不变时,反应物的浓度越大,化学反应速率越大.
| A. | v(O2)=0.001mol•L-1•s-1 | B. | v(NO)=0.0015 mol•L-1•s-1 | ||
| C. | v(H20)=0.003 mol•L-1•s-1 | D. | v(NH3)=0.001 mol•L-1•s-1 |