题目内容
12.天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.(1)①天然气中的少量H2S溶于水的电离方程式为H2S?H++HS-、HS-?H++S2-其中c( HS-)> c(S2-) (填“>”、“<”或“=”)请你提出增大其中c(S2-)的一种方法加入NaOH、Na2S等
②H2S可用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:H2S+Na2CO3=NaHS+NaHCO3.
(2)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)?2CO(g)+2H2(g).
①该反应的平衡常数表达式为K=$\frac{{c}^{2}(CO){•}^{\;}{c}^{2}({H}_{2})}{c(C{O}_{2})•c(C{H}_{4})}$.
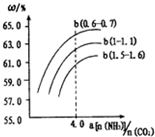
②在密闭容器中通入物质的量浓度均为0.1mol•L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强关系如题图-l所示.
则压强P1小于P2 (填“大于”或“小于”);压强为P2时,在Y点:v(正)大于v (逆)(填“大于“、“小于”或“等于“).
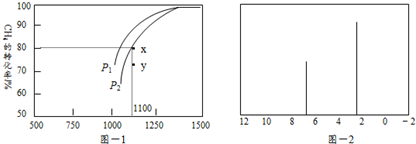
(3)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为l06,其核磁共振氢谱如题图-2所示,则X的结构简式为
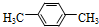 .
.
分析 (1)①硫化氢在溶液中为氢硫酸,氢硫酸为二元弱酸,电离分步进行;平衡右移可增大其中c(S2-);
②H2S可用Na2CO3溶液吸收,能生成两种酸式盐,依据硫化氢是二元酸,碳酸根离子为二元弱酸的酸根,所以生成的两种酸式盐为NaHS、NaHCO3,配平书写化学方程式;
(2)①根据化学平衡常数表达的意义书写,利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
②该反应正向为体积增大的方向,压强越大,CH4的转化率越小;压强为P2时,在Y点反应未达到平衡,则反应正向移动;
(3)已知X的相对分子质量为l06,设其分子式为CxHy,由$\frac{106}{12}$可知x=8,y=10,再根据质谱图中有2个峰,判断分子中含有2种环境的H.
解答 解:(1)①氢硫酸为二元弱酸,电离分步进行,电离方程式为H2S?H++HS-、HS-?H++S2-,电离以第一步为主,c( HS-)>c(S2-),加入NaOH、Na2S等碱性物质可以降低氢离子浓度使平衡右移,增大c(S2-),
故答案为:H2S?H++HS-、HS-?H++S2-;>;加入 NaOH、Na2S等;
②H2S可用Na2CO3溶液吸收,能生成两种酸式盐,说明反应产物为硫氢化钠和碳酸氢钠,反应的化学方程式为:H2S+Na2CO3═NaHS+NaHCO3,
故答案为:H2S+Na2CO3=NaHS+NaHCO3;
(2)①已知CO2(g)+CH4(g)?2CO(g)+2H2(g),其平衡常数表达式是K=$\frac{{c}^{2}(CO){•}^{\;}{c}^{2}({H}_{2})}{c(C{O}_{2})•c(C{H}_{4})}$,
故答案为:K=$\frac{{c}^{2}(CO){•}^{\;}{c}^{2}({H}_{2})}{c(C{O}_{2})•c(C{H}_{4})}$;
②该反应正向为体积增大的方向,压强越大,CH4的转化率越小,已知相同温度下,P1条件下的转化率大于P2,则P1小于P2;压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)大于v(逆);
故答案为:小于;大于;
(3)芳香烃X,已知X的相对分子质量为l06,设其分子式为CxHy,由$\frac{106}{12}$可知x=8,y=10,说明分子中含有一个苯环,另外含有2个C原子,再根据质谱图中有2个峰,可知分子中含有2种环境的H,则分子结构对称,所以其结构简式为 .
.
故答案为: ;
;
点评 本题考查了弱电解质的电离、方程式的书写、化学平衡常数、平衡移动、有机物分子式的确定等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.

| A. | 干冰升华时要吸收热量,所以这是吸热反应 | |
| B. | 化学反应中能量的变化都表现为热量的变化 | |
| C. | 1 mol Ba(OH)2与1 mol H2SO4反应释放的热量为Q,则Q为它们反 应的中和热 | |
| D. | 物质燃烧可看成“储存”在物质内部的能量(化学能)转化为热能 释放出来 |
| A. | 将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变小 | |
| B. | 常温下,向纯水中加入碳酸钠,水的电离程程度变大,Kw变大 | |
| C. | 化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变 | |
| D. | 已知,K=$\frac{{c}^{2}(C{O}_{2})•{c}^{6}({H}_{2})}{{c}^{3}({H}_{2}O)•c(C{H}_{3}C{H}_{2}OH)}$则对应的化学反应可以表示为:CH3CH2OH(g)+3H2O(g)?2CO2( g)+6H2(g) |
| A. | 氢处于第一周期 | B. | 第三周期元素全部是金属元素 | ||
| C. | 第二周期共有8种元素 | D. | 氯处于VⅡA族 |
| A. | C3H4;C5H8 | B. | C3H8;C5H12 | ||
| C. | CH3-CH2-CH2-CH3 ; | D. | C2H5Cl;C3H6Cl2 |

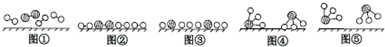
 、
、 、
、 分别表示N2、H2、NH3图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别 是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂
分别表示N2、H2、NH3图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别 是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂