题目内容
实验室常用Cu和浓硝酸反应来制取二氧化氮.反应方程式如下:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
该反应中,氧化剂与还原剂物质的量之比为 ,若将12.8g Cu置于一定量浓硝酸中,两者恰好完全反应.(假定溶液体积不变):
(1)生成的NO 2气体的体积(标准状况);
(2)反应中被还原的HNO3的物质的量;
(3)电子转移的物质的量.
该反应中,氧化剂与还原剂物质的量之比为
(1)生成的NO 2气体的体积(标准状况);
(2)反应中被还原的HNO3的物质的量;
(3)电子转移的物质的量.
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:(1)氧化还原反应中,化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂,根据参加反应的金属的量来计算生成气体的量;
(2)氧化还原反应中,化合价降低元素所在的反应物是氧化剂,在反应中被还原;
(3)根据参加反应的金属的量来确定电子的转移情况.
(2)氧化还原反应中,化合价降低元素所在的反应物是氧化剂,在反应中被还原;
(3)根据参加反应的金属的量来确定电子的转移情况.
解答:
解:反应Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O中,Cu元素化合价升高,失电子,是还原剂,氮元素化合价降低,得电子,硝酸只有一半氧化剂,电子转移的方向和数目如下: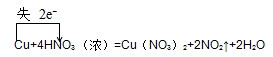 ,该反应的氧化剂和还原剂的物质的量之比为2:1,故答案为:2:1;
,该反应的氧化剂和还原剂的物质的量之比为2:1,故答案为:2:1;
(1)根据反应方程式,12.8g 即0.2molCu会和硝酸反应生成0.4mol二氧化氮,标准状况下的体积是:0.4mol×22.4L/mol=8.96L,答:生成的NO 2气体的体积(标准状况)是8.96L;
(2)氮元素化合价降低,得电子,4mol硝酸参加反应,只有一半作氧化剂,被还原,当12.8g 即0.2molCu反应时,消耗硝酸是0.8mol,被还原的HNO3的物质的量是0.4mol,答:反应中被还原的HNO3的物质的量是0.4mol;
(3)根据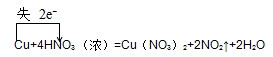 ,当12.8g 即0.2molCu反应时,转移电子是0.4mol,答:电子转移的物质的量是0.4mol.
,当12.8g 即0.2molCu反应时,转移电子是0.4mol,答:电子转移的物质的量是0.4mol.
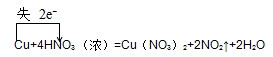 ,该反应的氧化剂和还原剂的物质的量之比为2:1,故答案为:2:1;
,该反应的氧化剂和还原剂的物质的量之比为2:1,故答案为:2:1;(1)根据反应方程式,12.8g 即0.2molCu会和硝酸反应生成0.4mol二氧化氮,标准状况下的体积是:0.4mol×22.4L/mol=8.96L,答:生成的NO 2气体的体积(标准状况)是8.96L;
(2)氮元素化合价降低,得电子,4mol硝酸参加反应,只有一半作氧化剂,被还原,当12.8g 即0.2molCu反应时,消耗硝酸是0.8mol,被还原的HNO3的物质的量是0.4mol,答:反应中被还原的HNO3的物质的量是0.4mol;
(3)根据
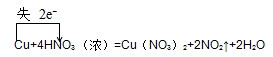 ,当12.8g 即0.2molCu反应时,转移电子是0.4mol,答:电子转移的物质的量是0.4mol.
,当12.8g 即0.2molCu反应时,转移电子是0.4mol,答:电子转移的物质的量是0.4mol.
点评:本题综合考查学生氧化还原反应中的基本概念和电子转移知识、根据方程式的计算等知识,注意知识的迁移和应用是关键,难度中等.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
已知:H2(g)+F2(g)═2HF(g)△H=-270kJ/mol,下列说法正确的是( )
| A、氟化氢气体分解生成氢气和氟气的反应是放热反应 |
| B、拆开1molH-H与1molF-F需要的总能量大于生成2molH-F释放的能量 |
| C、在相同条件下,1mol H2与1mol F2的能量总和大于2mol HF气体的能量 |
| D、1mol H2与1mol F2反应生成2mol液态HF放出的热量等于270kJ |
用一种试剂就能区分开苯酚、乙醇、NaOH溶液、AgNO3溶液、KSCN溶液这五种无色液体.它是( )
| A、溴水 |
| B、FeCl3溶液 |
| C、金属钠 |
| D、稀盐酸 |
 如图所示:
如图所示: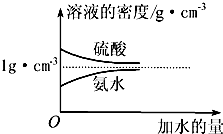 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题: (1)人类的生活和生产活动,可以说都离不开能源.在 ①石油、②电能、③风能、④煤、⑤天然气、⑥秸杆、⑦水力、⑧水煤气这些能源中,属于“二级能源”的是
(1)人类的生活和生产活动,可以说都离不开能源.在 ①石油、②电能、③风能、④煤、⑤天然气、⑥秸杆、⑦水力、⑧水煤气这些能源中,属于“二级能源”的是