题目内容
在密闭容器中,合成氨的反应为N2+3H2═2NH3,开始时 N2的浓度为8mol/L,5分钟后 N2的浓度为6mol/L,求这5分钟内N2的平均速率是多少?( 写计算过程)
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:化学反应速率:用单位时间内反应物浓度的减少或生成物浓度的增加来表示,根据化学反应速率的定义进行计算.
解答:
解:△c=c2-c1=8mol/L-6mol/L=2mol/L,v(N2)=
=
=0.4mol/(L?min),故这5分钟内N2的平均速率是0.4mol/(L?min),
答:这5分钟内N2的平均速率是0.4mol/(L?min).
| △c |
| t |
| 2mol/L |
| 5min |
答:这5分钟内N2的平均速率是0.4mol/(L?min).
点评:本题考查化学反应速率的相关计算,把握化学反应速率的定义为解答的关键,难度不大.

练习册系列答案
相关题目
25℃时,甲、乙、丙三个烧杯分别盛有25mL、浓度均为0.10mol?L-1的醋酸、氢氧化钠溶液和醋酸钠溶液.下列说法正确的是( )
| A、乙溶液和丙溶液混合后,Na+浓度仍为0.10mol?L-1 |
| B、甲溶液和乙溶液混合后所得溶液的pH和丙溶液相同 |
| C、若甲与丙两溶液混合后溶液显酸性,则c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-) |
| D、将丙溶液加到甲溶液中,则CH3COOH的电离平衡常数Ka变小 |
在反应A2+2AB2═4AB中,1gA2与足量的AB2反应生成5gAB,则A2与AB2的相对分子质量之比为( )
| A、1:4 | B、4:1 |
| C、1:2 | D、2:1 |
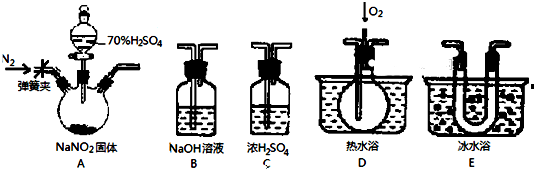



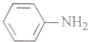 )具有
)具有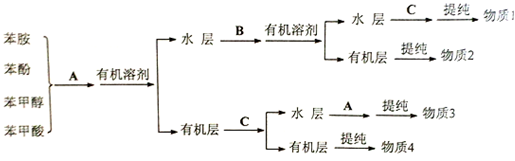
 转化为
转化为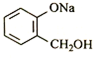 ,则应加入
,则应加入 实验室配制480mL 0.1mol?L-1NaOH溶液,回答下列问题
实验室配制480mL 0.1mol?L-1NaOH溶液,回答下列问题 ⑤间甲基苯乙烯
⑤间甲基苯乙烯