题目内容
5.下列物质的电子式书写正确的是( )| A. | Na2O | B. | H2S | C. | H2O2 | D. | N2 |
分析 A.氧化钠为离子化合物,少写1个钠离子;
B.H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键;
C.过氧化氢中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
D.氮气中存在3对共用电子对,氮原子最外层达到8个电子.
解答 解:A.氧化钠为离子化合物,钠离子直接用离子符号表示,阳离子需要标出最外层电子及所带的电荷,氧化钠的电子式为: ,故A错误;
,故A错误;
B.H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为: ,故B错误;
,故B错误;
C.过氧化氢为共价化合物,分子中存在两个氧氢键和一个O-O键,过氧化氢的电子式为: ,故C正确;
,故C正确;
D.氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为 ,故D错误;
,故D错误;
故选:C.
点评 本题考查了电子式的书写,题目难度不大,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
相关题目
7.下述实验能达到预期目的是( )
| 编号 | 实验操作 | 实验目的 |
| A | 将甲烷和乙烯的混合气体通过盛有溴水的洗气瓶 | 除去甲烷中混有的乙烯 |
| B | 在苯和苯酚的混合液中加入足量的浓溴水,振荡、过滤 | 分离出苯酚 |
| C | 向CH2=CHCHO溶液中滴入KMnO4酸性溶液 | 证明CH2=CHCHO中含有碳碳双键 |
| D | 先加NaOH溶液共热,然后加入AgNO3溶液 | 检验溴乙烷中含有溴元素 |
| A. | A | B. | B | C. | C | D. | D |
16.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 一定条件下,6.4 g铜与过量的硫反应,转移电子数目为0.2NA | |
| B. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| C. | 标准状况下,11.2L 水蒸气中含有3NA个原子 | |
| D. | 用石灰乳完全吸收1 mol Cl2时,转移电子的数目是NA |
13.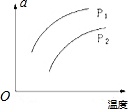 在容积一定的密闭容器中发生可逆反应X(g)+3Y(g)?nZ(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应X(g)+3Y(g)?nZ(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )
 在容积一定的密闭容器中发生可逆反应X(g)+3Y(g)?nZ(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应X(g)+3Y(g)?nZ(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )| A. | a可能表示混合气体的密度 | |
| B. | 若n=3,p1>p2,则a可表示Y的质量分数 | |
| C. | 若n=3,p1>p2,则a可表示Y的转化率 | |
| D. | a不可能表示混合气体的平均摩尔质量 |
10.下列物质之间的转化不能通过一步反应实现的是( )
| A. | Fe(OH)2→Fe(OH)3 | B. | FeCl3→FeCl2 | C. | Al2O3→Al(OH)3 | D. | Na2CO3→NaHCO3 |
17.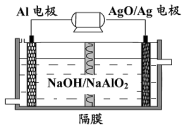 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.电池反应为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O下列说法中错误的是( )
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.电池反应为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O下列说法中错误的是( )
 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.电池反应为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O下列说法中错误的是( )
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.电池反应为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O下列说法中错误的是( )| A. | 该装置可实现化学能向电能的转化 | B. | 电池工作时AgO得到电子 | ||
| C. | Al是负极 | D. | OH-透过隔膜向AgO/Ag极迁移 |
14.某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,SO42-的物质的量浓度为9mol/L,加入足量铁粉,则反应后的溶液中Fe2+离子浓度为(假设反应前后溶液体积不变)( )
| A. | 4.5mol/L | B. | 18mol/L | C. | 3mol/L | D. | 9mol/L |
15.分类是化学学习与研究的常用方法,下列分类正确的是( )
| A. | SiO2、SO2、SO3均属于酸性氧化物 | |
| B. | H2SiO3、H2SO3、H2SO4均属于强酸 | |
| C. | 根据是否具有丁达尔效应,将分散系分为溶液、胶体和浊液 | |
| D. | 根据是否能导电,将物质分为电解质和非电解质 |