题目内容
9.室温下,下列溶液中粒子的物质的量浓度关系正确的是 (?)| A. | 0.lmol/L NaHS溶液:c(H+)+c(Na+)=c(S2-)+c(HS-)+c(OH-) | |
| B. | 浓度均为0.1 mol/L的 ①NH4Cl ②NH4HSO4③NH4HCO3三种溶液,其中c(NH4+):③>①>② | |
| C. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 0.lmol/L Na2C03溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.lmol/L |
分析 A.根据电荷守恒可知,溶液中存在阴离子为S2-、HS-、0H-,阳离子为H+、Na+,阳离子所带电荷总数等于阴离子所带电荷总数;
B.②NH4HS04电离产生的氢离子对铵根离子的水解起抑制作用,而③NH4HC03电离出的碳酸氢根离子对铵根离子的水解起促进作用;
C.pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合,促进醋酸电离溶液呈酸性;
D.根据物料守恒,碳元素在溶液中所有存在形式的浓度之和为O.lmol/L;
解答 解:A.根据电荷守恒可知,c(H+)+c(Na+)=2c(S2-)+c(HS-)+c(0H-),故A错误;
B.②NH4HS04电离产生的氢离子对铵根离子的水解起抑制作用,而③NH4HC03电离出的碳酸氢根离子对铵根离子的水解起促进作用,所以其中c(NH4+):③<①<②,故B错误;
C.醋酸是弱酸,溶液中存在电离平衡,pH=11的NaOH溶液与pH=3的CH3COOH溶液,氢氧根离子浓度和醋酸平衡状态下电离出的氢离子浓度相同,等体积混合,促进醋酸电离溶液呈酸性,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D.根据物料守恒,碳元素在溶液中所有存在形式的浓度之和为O.lmol/L,所以c(H2C03)+c(HC03-)+c(C032-)=O.lmol/L,故D正确;
故选D.
点评 本题考查离子浓度大小的比较,难度中等,熟悉盐的水解和物料守恒、电荷守恒的相关知识,水解与电离的程度及相互影响是解答本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.在一定条件下,能使A(g)+B(g)?C(g)+D(g)正反应速率增大的措施是( )
| A. | 减小C和D的浓度 | B. | 增大D的浓度 | C. | 减小B的浓度 | D. | 增大A和B的浓度 |
14. 下列有关如图所示装置的叙述中错误的是( )
下列有关如图所示装置的叙述中错误的是( )
①这是电解NaOH溶液的装置
②Pt为正极,其电极反应为:O2+2H2O+4e-═4OH-
③Fe为阳极,其电极反应为:Fe+2OH--2e-═2Fe(OH)2
④这是一个化学能转化为电能的装置.
 下列有关如图所示装置的叙述中错误的是( )
下列有关如图所示装置的叙述中错误的是( )①这是电解NaOH溶液的装置
②Pt为正极,其电极反应为:O2+2H2O+4e-═4OH-
③Fe为阳极,其电极反应为:Fe+2OH--2e-═2Fe(OH)2
④这是一个化学能转化为电能的装置.
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
1.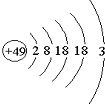 张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
 张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )| A. | In为长周期元素 | B. | In为过渡金属元素 | ||
| C. | In容易导电导热 | D. | In在反应中容易失电子 |
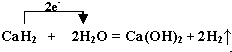 .
.